TEORIA DEGLI ALDEIDI E DEI CHETONI
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 213219
Le aldeidi prendono il nome sostituendo la desinenza -o dell'alcano corrispondente con -ale . Non è necessario specificare la posizione del gruppo aldeidico, poiché occupa l'estremità della catena (locante 1).
Quando la stringa contiene due funzioni aldeidiche, viene utilizzato il suffisso -diale .
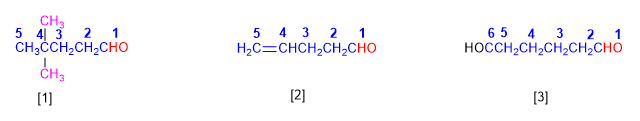
[1] 4,4-Dimetilpentanale
[2] Pent-4-enale
[3] Esandiale
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 142492
Aldeidi e chetoni possono essere preparati mediante ossidazione di alcoli, ozonolisi di alcheni, idratazione di alchini e acilazione di Friedel-Crafts come metodi principali.
a) Ozonolisi degli alcheni: gli alcheni si decompongono con l'ozono per formare aldeidi e/o chetoni. Se l'alchene ha idrogeni vinilici dà aldeidi. Se ha due catene di carbonio forma chetoni. 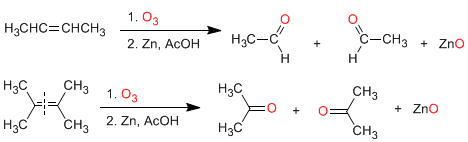
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 69885
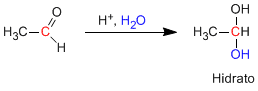
Aldeidi e chetoni reagiscono in un mezzo acido acquoso per formare idrati. Il meccanismo si compone di tre fasi. La prima e più veloce è la protonazione dell'ossigeno carbonilico. Questa protonazione produce un aumento di polarità sul carbonio e favorisce l'attacco del nucleofilo. Nella seconda fase, l'acqua attacca il carbonio carbonilico, è la fase lenta del meccanismo. Nella terza fase si verifica la deprotonazione dell'ossigeno, formando l'idrato finale.
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 94708
Gli emiacetali si formano facendo reagire un equivalente di alcol con il gruppo carbonile di un'aldeide o chetone. Questa reazione è catalizzata da acido ed è equivalente alla formazione di idrati.
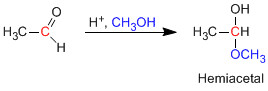
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 87761
Aldeidi e chetoni reagiscono con gli alcoli in condizioni di catalisi acida, formando emiacetali in un primo stadio, che successivamente evolvono per reazione con un secondo equivalente di alcol ad acetali. 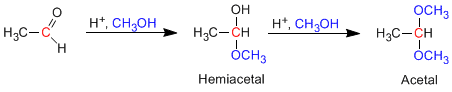
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 66353
1,2- e 1,3-dioli reagiscono con aldeidi e chetoni per formare acetali ciclici. Gli equilibri vengono spostati verso il prodotto finale rimuovendo l'acqua formata dall'azeotropizzazione con benzene o toluene.
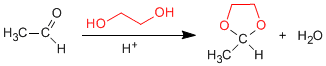
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 54397
 Gli acetali possono essere usati, grazie alla loro stabilità, come gruppi protettivi carbonilici. L'acetale è un etere, molto stabile nei mezzi basici, sebbene si rompa in presenza di mezzi acidi. In molti processi di sintesi, il gruppo carbonile è incompatibile con il reagente utilizzato. In questi casi va protetto per evitare che reagisca. L'instabilità dell'acetale in un mezzo acido può essere utilizzata per deproteggere il carbonile.
Gli acetali possono essere usati, grazie alla loro stabilità, come gruppi protettivi carbonilici. L'acetale è un etere, molto stabile nei mezzi basici, sebbene si rompa in presenza di mezzi acidi. In molti processi di sintesi, il gruppo carbonile è incompatibile con il reagente utilizzato. In questi casi va protetto per evitare che reagisca. L'instabilità dell'acetale in un mezzo acido può essere utilizzata per deproteggere il carbonile.
Vediamo alcuni esempi:
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 83749
La reazione di aldeidi o chetoni [1] con ammine primarie genera immine [2]. La reazione è favorita in ambiente leggermente acido (pH=4.5). 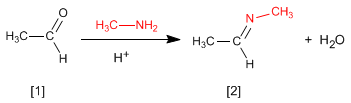
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 61325
Ossime sono ottenuti per reazione di aldeidi o chetoni e idrossilammina in ambiente debolmente acido. Il meccanismo è analogo a quello della formazione dell'immina. 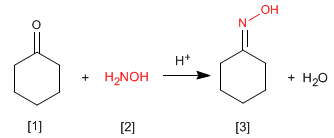
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 56579
Gli idrazoni [3] sono ottenuti per reazione di aldeidi o chetoni [1] con idrazina [2]. Come nel caso di immine e ossime, richiede pH=4. 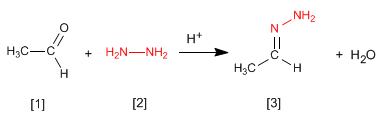
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 31148
Idrazina [2] reagisce con due molecole di aldeide [1] formare azine [3]. 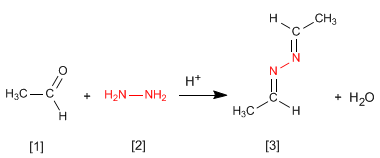
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 35333
Semicarbazoni [3] sono ottenuti per reazione di aldeidi o chetoni [1] con semicarbazide [2]. Vediamo un esempio: 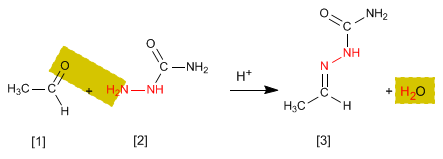
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 89467
È un test analitico specifico per aldeidi e chetoni. Carbonili [1] reagire con 2,4-dinitrofenilidrazina [2] formazione di fenilidrazoni [3] che precipitano in giallo. La comparsa di un precipitato è un indicatore della presenza di carbonili nel mezzo. 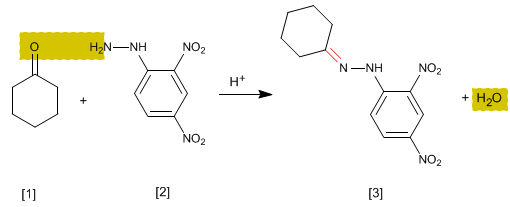
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 38113
Sintesi dell'enamina
Come abbiamo visto nelle sezioni precedenti, la condensazione di ammine primarie con aldeidi e chetoni genera immine. In questa sezione studieremo la condensazione di carbonili con ammine secondarie che danno enammine.
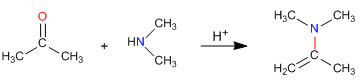
Meccanismo di formazione dell'enammina
Dopo l'attacco iniziale dell'ammina secondaria sul carbonile, l'acqua viene rimossa, formando il doppio legame tra il carbonio carbonilico e l'alfa del carbonile di partenza.
Fas 1. Protonazione del carbonile
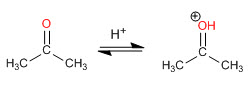
Fase 2. Attacco nucleofilo dell'ammina secondaria
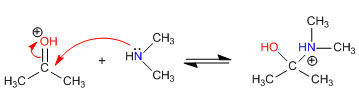
Fase 3. Equilibrio acido-base
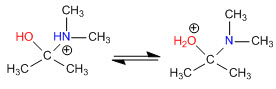
Fase 4. Perdita di acqua
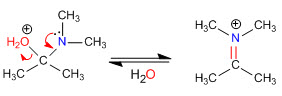
Fase 5. Eliminazione
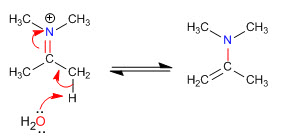
Gli impedimenti sterici rendono le enammine meno sostituite le più stabili
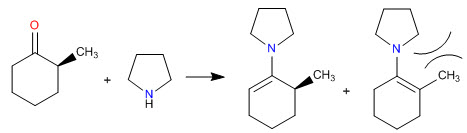
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 58369
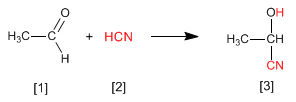
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 65942
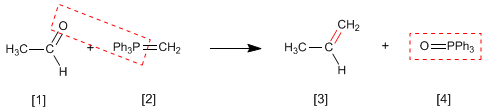
- Dettagli
- Germán Fernández
- TEORIA DEGLI ALDEIDI E DEI CHETONI
- Visite: 58917
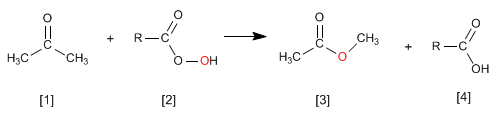
La reazione chetonica con peracidi produce esteri . L'ossigeno del peracido è inserito tra il carbonio carbonilico e il carbonio alfa del chetone. Questa reazione fu descritta da Adolf von Baeyer e Victor Villiger nel 1899.