ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 212009
Альдегиды получают название путем добавления окончания -аль к названию алкана, из которого они получены. Положение альдегидной группы указывать не нужно, так как она занимает конец цепи (локант 1).
Когда строка содержит две альдегидные функции, используется суффикс -диал .
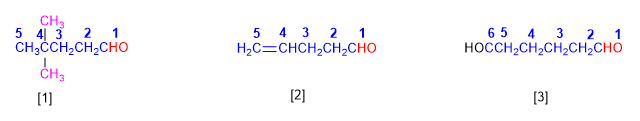
[1] 4,4-диметилпентаналь
[2] Пент-4-энал
[3] 6-гидроксигексаналь
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 141391
Альдегиды и кетоны могут быть получены окислением спиртов, озонолизом алкенов, гидратацией алкинов и ацилированием Фриделя-Крафтса в качестве основных методов.
а) Озонолиз алкенов: алкены разлагаются озоном с образованием альдегидов и/или кетонов. Если алкен имеет виниловые атомы водорода, он дает альдегиды. Если он имеет две углеродные цепи, он образует кетоны. 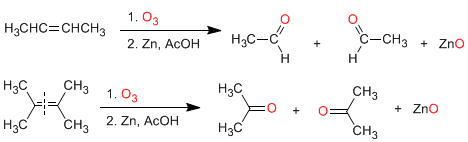
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 69030
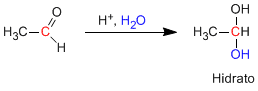
Альдегиды и кетоны реагируют в водно-кислой среде с образованием гидратов. Механизм состоит из трех ступеней. Первым и самым быстрым является протонирование карбонильного кислорода. Это протонирование вызывает увеличение полярности углерода и способствует атаке нуклеофила. На второй стадии вода атакует карбонильный углерод, это медленная стадия механизма. На третьей стадии происходит депротонирование кислорода с образованием конечного гидрата.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 90348
Полуацетали образуются при взаимодействии одного эквивалента спирта с карбонильной группой альдегида или кетона. Эта реакция катализируется кислотой и эквивалентна образованию гидратов.
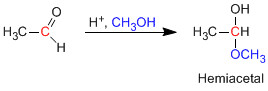
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 85372
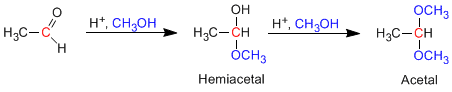
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 60841
1,2- и 1,3-диолы реагируют с альдегидами и кетонами с образованием циклических ацеталей. Равновесия смещаются в сторону конечного продукта путем удаления воды, образующейся при азеотропной перегонке с бензолом или толуолом.
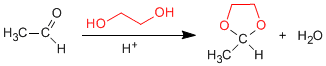
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 51629
 Благодаря своей стабильности ацетали можно использовать в качестве карбонильных защитных групп. Ацеталь представляет собой эфир, очень устойчивый в основных средах, хотя и разрушается в присутствии кислых сред. Во многих процессах синтеза карбонильная группа несовместима с используемым реагентом. В этих случаях он должен быть защищен, чтобы предотвратить его реакцию. Нестабильность ацеталя в кислой среде может быть использована для снятия защиты с карбонила.
Благодаря своей стабильности ацетали можно использовать в качестве карбонильных защитных групп. Ацеталь представляет собой эфир, очень устойчивый в основных средах, хотя и разрушается в присутствии кислых сред. Во многих процессах синтеза карбонильная группа несовместима с используемым реагентом. В этих случаях он должен быть защищен, чтобы предотвратить его реакцию. Нестабильность ацеталя в кислой среде может быть использована для снятия защиты с карбонила.
Давайте посмотрим несколько примеров:
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 81334
Реакция альдегидов или кетонов с первичными аминами образует имин . Реакция протекает в слабокислой среде (pH=4,5). 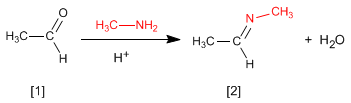
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 61073
Оксимы [3] получают реакцией альдегидов или кетонов [1] и гидроксиламина [2] в слабокислой среде. Механизм аналогичен механизму образования имина. 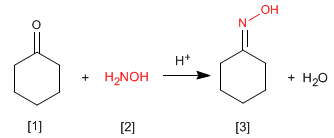
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 55581
Гидразоны [3] получают взаимодействием альдегидов или кетонов [1] с гидразином [2] . Как и в случае иминов и оксимов, требуется pH=4.
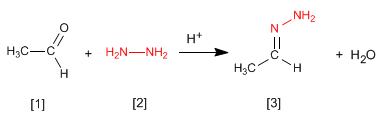
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 31117
Гидразин [2] реагирует с двумя молекулами альдегида [1] с образованием азинов [3]. 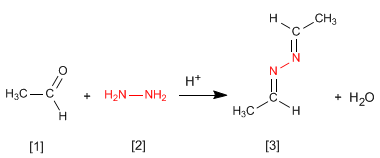
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 35006
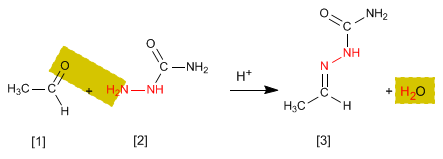
Семикарбазоны [3] получают взаимодействием альдегидов или кетонов [1] с семикарбазидом [2] . Давайте посмотрим пример:
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 87190
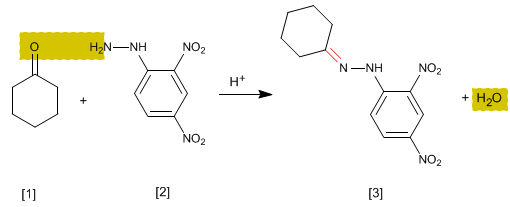
Это специальный аналитический тест на альдегиды и кетоны. Карбонилы [1] реагируют с 2,4-динитрофенилгидразином [2] с образованием фенилгидразонов [3] , выпадающих в осадок желтого цвета. Появление осадка является показателем наличия в среде карбонилов.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 35566
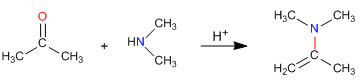
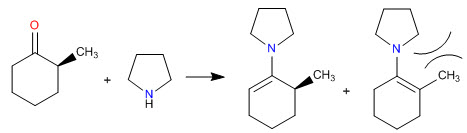
синтез енамина
Как мы видели в предыдущих разделах, конденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов. В этом разделе мы изучим конденсацию карбонилов с вторичными аминами, дающими енамины.
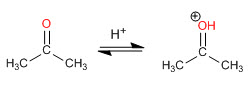
Механизм образования енамина
После начальной атаки вторичного амина на карбонил вода удаляется, образуя двойную связь между карбонильным углеродом и альфа исходного карбонила.
Стадия 1. Протонирование карбонила
Стадия 2. Нуклеофильная атака вторичного амина
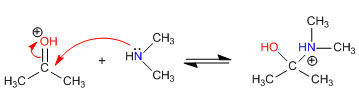
Этап 3. Кислотно-щелочной баланс
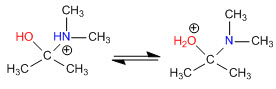
Этап 4. Потеря воды
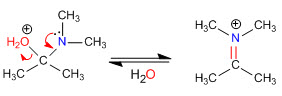
Этап 5. Ликвидация
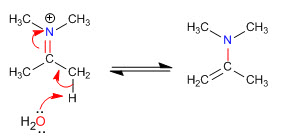
Стерические затруднения делают наименее замещенные енамины наиболее стабильными.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 58057
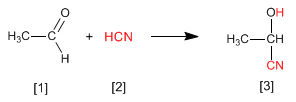
Цианогидрины [3] образуются при взаимодействии альдегидов или кетонов [1] с синильной кислотой [2] и представляют собой соединения, содержащие цинан и гидроксильную группу на одном и том же углероде.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 65920
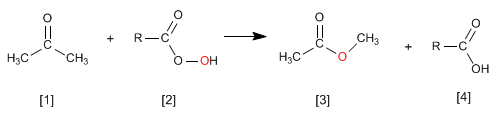
Реакция Виттига использует илиды фосфора [2] для превращения альдегидов и кетонов [1] в алкены [3] . Побочным продуктом является оксид трифенилфосфина [4]. 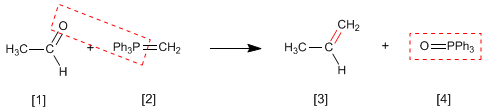
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АЛЬДЕГИДОВ И КЕТОНОВ
- Просмотров: 58657
Реакция кетонов [1] с надкислотами [2] приводит к образованию сложных эфиров [3] . Кислород надкислоты вставлен между карбонильным углеродом и альфа-углеродом кетона. Эта реакция была описана Адольфом фон Байером и Виктором Филлигером в 1899 году.