THEORIE DER ALDEHYDE UND KETONE
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 212823
Aldehyde werden benannt, indem man die Endung -al an den Namen des Alkans anhängt, von dem sie abstammen.. Die Position der Aldehydgruppe muss nicht angegeben werden, da sie das Kettenende (Lokant 1) einnimmt.
Wenn die Zeichenfolge zwei Aldehydfunktionen enthält, wird das Suffix -dial verwendet.
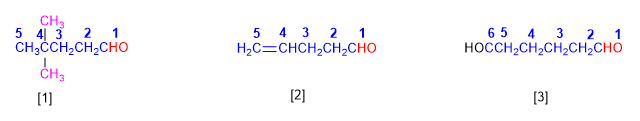
[1] 4,4-Dimethylpentanal
[2] Pent-4-enal
[3] Hexanodial
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 141628
Aldehyde und Ketone können durch Oxidation von Alkoholen, Ozonolyse von Alkenen, Hydratation von Alkinen und Friedel-Crafts-Acylierung als Hauptverfahren hergestellt werden.
a) Ozonolyse von Alkenen: Alkene zerfallen mit Ozon zu Aldehyden und/oder Ketonen. Wenn das Alken Vinylwasserstoffe hat, ergibt es Aldehyde. Wenn es zwei Kohlenstoffketten hat, bildet es Ketone. 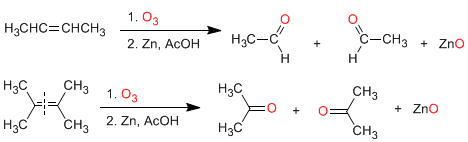
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 70596
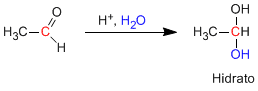
Aldehyde und Ketone reagieren in wässrigem saurem Medium zu Hydraten. Der Mechanismus besteht aus drei Stufen. Die erste und schnellste ist die Protonierung von Carbonylsauerstoff. Diese Protonierung bewirkt eine Erhöhung der Polarität am Kohlenstoff und begünstigt den Angriff des Nucleophils. In der zweiten Stufe greift das Wasser den Carbonylkohlenstoff an, es ist die langsame Stufe des Mechanismus. In der dritten Stufe erfolgt die Sauerstoffdeprotonierung, wodurch das endgültige Hydrat gebildet wird.
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 89398
Halbacetale werden gebildet, indem ein Äquivalent Alkohol mit der Carbonylgruppe eines Aldehyds oder Ketons umgesetzt wird. Diese Reaktion ist säurekatalysiert und entspricht der Bildung von Hydraten.
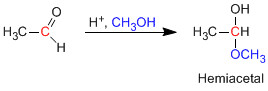
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 85232
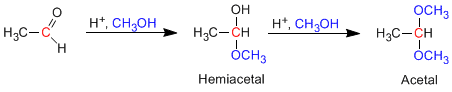
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 61526
1,2- und 1,3-Diole reagieren mit Aldehyden und Ketonen zu cyclischen Acetalen. Die Gleichgewichte werden in Richtung Endprodukt verschoben, indem das gebildete Wasser durch Azeotropierung mit Benzol oder Toluol entfernt wird.
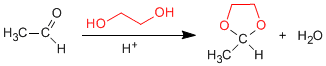
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 52462
 Acetale können aufgrund ihrer Stabilität als Carbonylschutzgruppen verwendet werden. Das Acetal ist ein Ether, sehr stabil in basischen Medien, obwohl es in Gegenwart von sauren Medien bricht. Bei vielen Syntheseverfahren ist die Carbonylgruppe mit dem verwendeten Reagenz unverträglich. In diesen Fällen muss es geschützt werden, damit es nicht reagieren kann. Die Instabilität des Acetals in einem sauren Medium kann genutzt werden, um das Carbonyl zu entschützen.
Acetale können aufgrund ihrer Stabilität als Carbonylschutzgruppen verwendet werden. Das Acetal ist ein Ether, sehr stabil in basischen Medien, obwohl es in Gegenwart von sauren Medien bricht. Bei vielen Syntheseverfahren ist die Carbonylgruppe mit dem verwendeten Reagenz unverträglich. In diesen Fällen muss es geschützt werden, damit es nicht reagieren kann. Die Instabilität des Acetals in einem sauren Medium kann genutzt werden, um das Carbonyl zu entschützen.
Sehen wir uns einige Beispiele an:
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 85584
Die Reaktion von Aldehyden oder Ketonen mit primären Aminen erzeugt Imine . Die Reaktion wird in leicht saurem Medium (pH = 4,5) begünstigt. 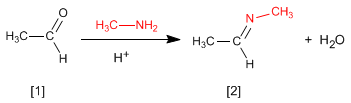
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 60481
Die Oxime [3] werden durch Umsetzung von Aldehyden oder Ketonen [1] und Hydroxylamin [2] in schwach saurem Medium erhalten. Der Mechanismus ist analog zu dem der Iminbildung. 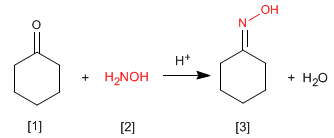
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 56542
Hydrazone [3] werden durch Umsetzung von Aldehyden oder Ketonen [1] mit Hydrazin [2] erhalten. Wie im Fall von Iminen und Oximen erfordert es pH = 4.
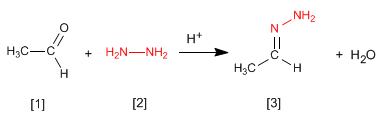
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 31119
Hydrazin [2] reagiert mit zwei Aldehydmolekülen [1] zu Azinen [3]. 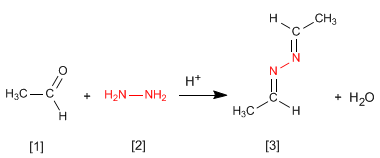
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 35709
Semicarbazone [3] werden durch Umsetzung von Aldehyden oder Ketonen [1] mit Semicarbazid [2] erhalten. Sehen wir uns ein Beispiel an:
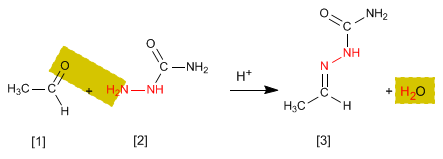
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 87063
Es ist ein spezifischer analytischer Test für Aldehyde und Ketone. Carbonyle [1] reagieren mit 2,4-Dinitrophenylhydrazin [2] zu Phenylhydrazonen [3] , die gelb ausfallen. Das Auftreten eines Niederschlags ist ein Indikator für das Vorhandensein von Carbonylen im Medium.
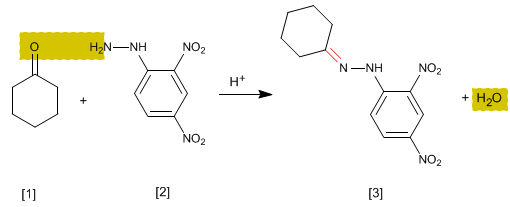
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 38171
Enamin-Synthese
Wie wir in den vorherigen Abschnitten gesehen haben, entstehen bei der Kondensation von primären Aminen mit Aldehyden und Ketonen Imine. In diesem Abschnitt untersuchen wir die Kondensation von Carbonylen mit sekundären Aminen, die Enamine ergeben.
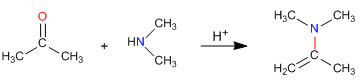
Mechanismus der Enaminbildung
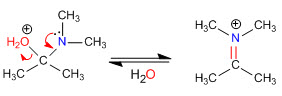
Nach dem anfänglichen Angriff des sekundären Amins auf das Carbonyl wird Wasser entfernt, wodurch die Doppelbindung zwischen dem Carbonyl-Kohlenstoff und dem Alpha des Ausgangs-Carbonyls gebildet wird.
Schritt 1. Protonierung des Carbonyls
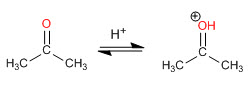
Schritt 2. Nucleophiler Angriff des sekundären Amins
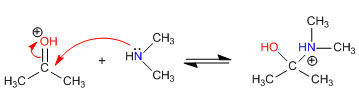
Stufe 3. Säure-Basen-Gleichgewicht
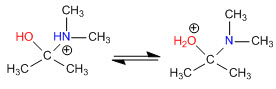
Stufe 4. Wasserverlust
Stufe 5. Elimination
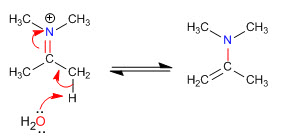
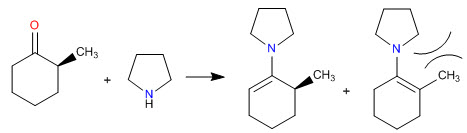
Sterische Hinderungen machen die am wenigsten substituierten Enamine zu den stabilsten
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 60149
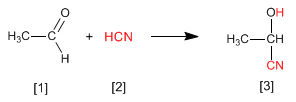
Cyanhydrine [3] werden durch die Reaktion von Aldehyden oder Ketonen [1] mit Blausäure [2] gebildet und sind Verbindungen, die eine Cynan- und eine Hydroxygruppe am selben Kohlenstoff enthalten.
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 65990
Die Wittig-Reaktion verwendet Phosphorylide [2] , um Aldehyde und Ketone [1] in Alkene [3] umzuwandeln. Als Nebenprodukt fällt Triphenylphosphinoxid an [4]. 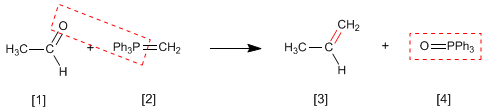
- Details
- Germán Fernández
- THEORIE DER ALDEHYDE UND KETONE
- Zugriffe: 59012
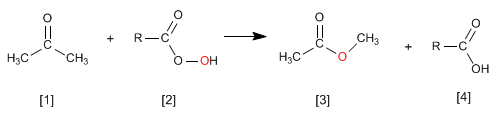
Die Reaktion von Ketonen [1] mit Persäuren [2] erzeugt Ester [3] . Der Sauerstoff der Persäure wird zwischen dem Carbonylkohlenstoff und dem Alpha-Kohlenstoff des Ketons eingefügt. Diese Reaktion wurde 1899 von Adolf von Baeyer und Victor Villiger beschrieben.