TEORIA DEL BENZENE
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 150937
I benzeni monosostituiti sono denominati terminando il nome del sostituente in benzene.
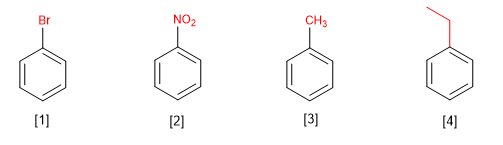
[1] Bromobenzene
[2] Nitrobenzene
[3] Metilbenzene (toluene)
[4] Etilbenzene
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 86889
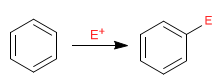
Il benzene agisce come un nucleofilo, attaccando un numero ampio e vario di elettrofili.
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 125353
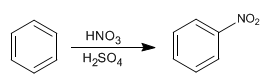
Il benzene reagisce con la miscela nitrico-solforica aggiungendo gruppi nitro.
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 119023
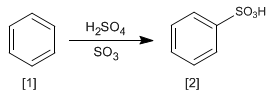
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 103724
Il benzene reagisce con gli alogeni in presenza di acidi di Lewis per formare derivati alogenati.
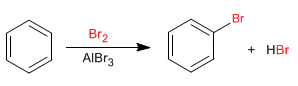
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 74012
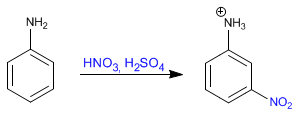
Leggi tutto: Benzene - Protezione e deprotezione del gruppo amminico
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 4408
Il gruppo amminico viene introdotto nell'anello aromatico mediante riduzione del nitro.
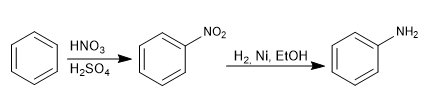
I reagenti utilizzati nella riduzione possono essere:
- Sn, HCl
- H2 , Ni, EtOH
- Fe, HCl
Leggi tutto: Riduzione di nitro ad ammino e ossidazione di ammino a nitro
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 3045
La reversibilità della solfonazione ne consente l'utilizzo per proteggere le posizioni attivate del benzene. Vediamo un esempio:
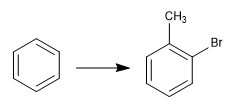
Per ottenere l'o-bromotoluene, eseguiamo i seguenti passaggi:
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 9261
La reazione dell'1-cloro-2,4-dinitrobenzene con i nucleofili (idrossido, ammoniaca, metossido, ecc.) produce la sostituzione del cloro con il corrispondente nucleofilo. Si chiama ipso (stesso posto), per indicare che il nucleofilo occupa la stessa posizione del cloro di partenza.
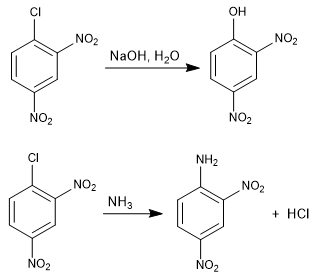
Leggi tutto: Sostituzione nucleofila aromatica per addizione-eliminazione
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 56622
I benzeni alogenati reagiscono con la soda diluita in condizioni di alta pressione e temperatura per formare fenoli. Questa reazione non richiede la disattivazione di gruppi in posizione orto/para e segue un meccanismo diverso dalla sostituzione nucleofila aromatica per addizione-eliminazione.
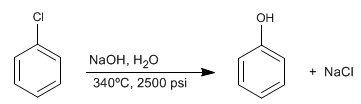
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 4688
Il carbonio attaccato direttamente al benzene è noto come posizione benzilica. In questa posizione si formano carbocationi, carbanioni e radicali molto stabili grazie alla possibilità di delocalizzazione della carica sull'anello aromatico.
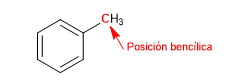
SN1 in posizioni benziliche
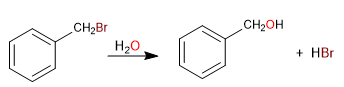
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 5056
Ossidazione di catena con permanganato e bicromato
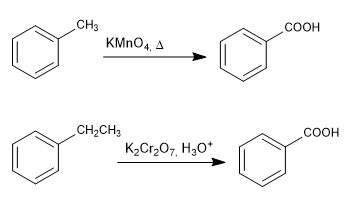
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 4511
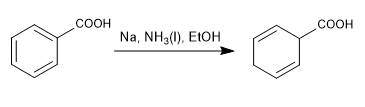
La riduzione di Birch utilizza sodio o litio in soluzione come reagenti, il suo meccanismo è radicale e riduce il benzene a 1,4-cicloesadiene.
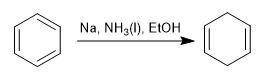
Birch con sostituenti attivanti
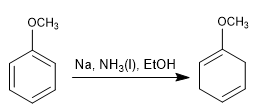
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 4571
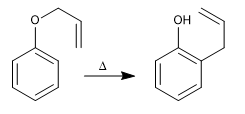
Gli allil fenil eteri subiscono una reazione concertata quando vengono riscaldati, coinvolgendo il movimento di sei elettroni, chiamato riarrangiamento di Claisen. L'intermedio formato nella reazione è di alta energia e tautomerizza rapidamente per dare il prodotto finale.
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 4107
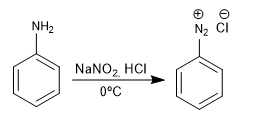
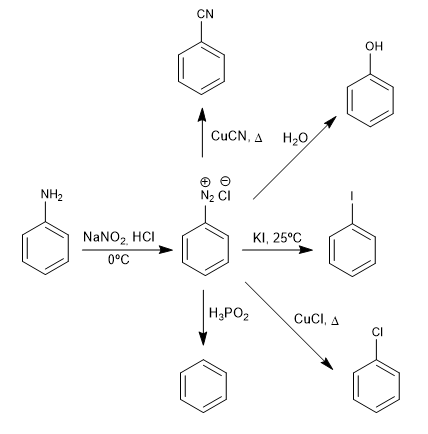
I sali di benzenediazonio vengono attaccati dai nucleofili in presenza di sali di rame (I) che fungono da catalizzatore, ottenendo un'ampia varietà di prodotti.
- Dettagli
- Germán Fernández
- TEORIA DEL BENZENE
- Visite: 3060
Formazione di composti azoici