Le ammine hanno idrogeni acidi sul gruppo amminico. Questi idrogeni possono essere sottratti utilizzando basi forti (organometalliche, idruri metallici) formando ammidi (basi amminiche).
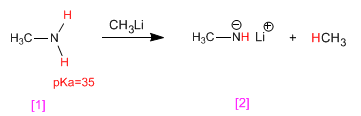
Metilammina [1] reagisce con il metillitio, trasformandosi nella sua base coniugata, il litio metilammide [2] . Da parte sua, il metillitio si trasforma nel suo acido coniugato, il metano.
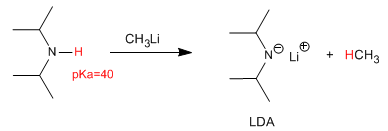
La deprotonazione della diisopropilammina produce una delle basi più utilizzate in chimica organica, la litio diisopropilammide (LDA).
Tuttavia, il comportamento più importante delle ammine è di base. Le ammine sono le sostanze organiche neutre più basilari.
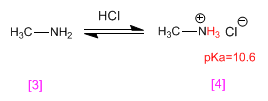
Metilammina [3] viene protonato diventando cloruro di metilammonio (sale di ammonio) [4] . I sali di ammonio sono gli acidi coniugati delle ammine e hanno pKa compreso tra 9 e 11.
La basicità delle ammine dipende dagli effetti induttivi e sterici. Pertanto, il pKa aumenta con la lunghezza della catena di carbonio (effetto induttivo).
CH3NH2 pKa = 10,6
CH 3 CH 2 NH 2 pKa=10,8
(CH 3 ) 3 CNH 2 pKa=10,4
La catena carboniosa dà carica al gruppo amminico, per effetto induttivo, aumentandone la basicità. La base forte ha un acido coniugato debole, quindi il pKa aumenta. Ma se la catena è molto voluminosa, gli effetti sterici iniziano a prevalere, causando una diminuzione del pKa.