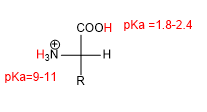
 La presenza di gruppi acido (-COOH) e basico (-NH2) conferisce agli amminoacidi caratteristiche acido-base.
La presenza di gruppi acido (-COOH) e basico (-NH2) conferisce agli amminoacidi caratteristiche acido-base.
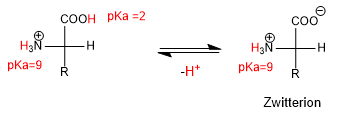
Nei mezzi acidi forti, sia il gruppo amminico che il gruppo acido sono protonati e l'amminoacido ha la seguente forma:
All'aumentare del pH, il gruppo più acido, H con un pKa inferiore, viene deprotonato, formando una specie neutra chiamata Zwitterion.
Quando l'amminoacido si trova in un mezzo basico, perde il protone del gruppo amminico, dando origine alle specie deprotonate.
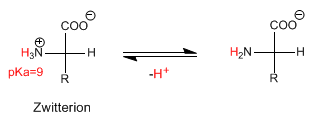
Il pH al quale la concentrazione di Zwitterion è massima (l'amminoacido non ha carica netta) è chiamato pH isoelettrico o punto isoelettrico.
Un'altra definizione di punto isoelettrico è: pH al quale la concentrazione di specie protonate e deprotonate si equalizza.
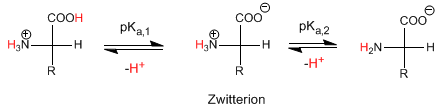
Il pH isoelettrico è calcolato come media di pKa,1 e pKa,2 , cioè media dei pKas degli stadi che formano e decompongono lo Zwitterion.