Come abbiamo visto al punto precedente, gli alchini terminali hanno idrogeni acidi che possono essere rimossi da basi forti, formando acetiluri (base coniugata dell'alchino). Gli acetilidi sono buoni nucleofili e forniscono meccanismi di sostituzione nucleofila con substrati primari.
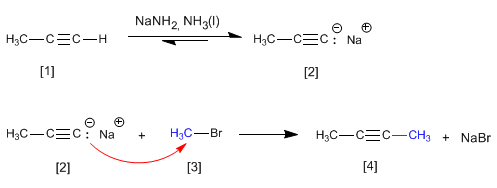
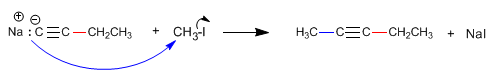
Il propino reagisce con l'ammide di sodio in ammoniaca liquida per formare propinil sodio. Nella seconda fase, il propinile di sodio attacca il bromuro di metile come nucleofilo per formare 2-butino. In questa reazione, l'alchino viene alchilato, formando un legame carbonio-carbonio che aumenta la dimensione della catena di carbonio.
La formazione di legami carbonio-carbonio è di grande importanza nella sintesi organica, consentendo la costruzione di grandi molecole da quelle più piccole.
La reazione di alchilazione può essere effettuata solo con aloalcani primari. Pertanto, il bromuro di isopropile (substrato secondario) genera propene per reazione con propinil sodio, attraverso il meccanismo E2.
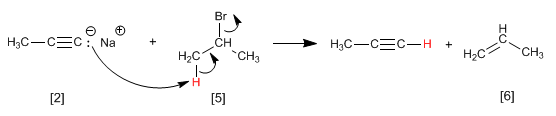
Esempio: Ottenere 2-pentyne da acetilene
Passaggio 1. Deprotonazione dell'acetilene con ammide di sodio
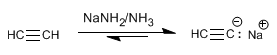
Passaggio 2. Alchilazione con ioduro di etile
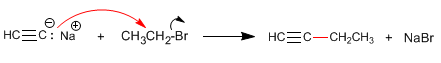
Passaggio 3. Deprotonazione di 1-butin
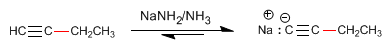
Passaggio 4. Alchilazione di 1-butinil sodico con ioduro di metile