Gli alcani sono composti ibridati sp3 su tutti i carboni. I quattro sostituenti che partono da ciascun carbonio sono disposti verso i vertici di un tetraedro.
Le distanze e gli angoli di legame sono mostrati sui seguenti modelli. 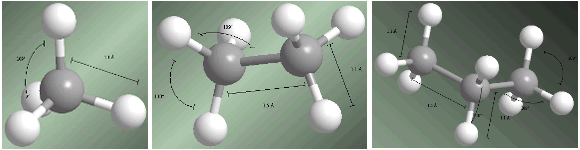
Gli alcani più piccoli, metano, etano, propano e butano, sono gas a temperatura ambiente. Gli alcani lineari da C5H12 a C17H36 sono liquidi. alcani di  un numero maggiore di atomi di carbonio sono solidi a temperatura ambiente.
un numero maggiore di atomi di carbonio sono solidi a temperatura ambiente.
I punti di fusione e di ebollizione degli alcani aumentano con il numero di atomi di carbonio nella molecola. Si osserva inoltre che gli alcani ramificati hanno un punto di ebollizione inferiore rispetto ai loro isomeri lineari.
Il grafico seguente mostra i punti di ebollizione degli alcani lineari (in nero) e quelli corrispondenti ai loro isomeri 2-metilalcani (in blu). 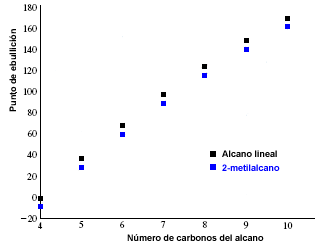
Nella fase liquida ci sono forze di attrazione tra le molecole che le tengono insieme. Per far passare la sostanza alla fase gassosa è necessario vincere queste forze intermolecolari attraverso l'apporto di energia. 
Nelle molecole neutre, come gli alcani, le forze attrattive sono dovute alle interazioni di van der Waals che possono essere di tre tipi: dipolo-dipolo, dipolo-dipolo indotto e dipolo-dipolo indotto.
La formazione di dipoli indotti che producono l'attrazione tra molecole neutre può essere vista nel seguente schema: 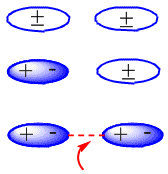
Consideriamo gli isomeri del pentano, come esempio della diminuzione del punto di ebollizione, passando da alcani lineari a ramificati.
Il pentano ha un'ampia superficie che consente un gran numero di interazioni dipolo-dipolo indotte. Il 2-metilbutano è più compatto e ha una superficie inferiore, minori interazioni intermolecolari e un punto di ebollizione inferiore.