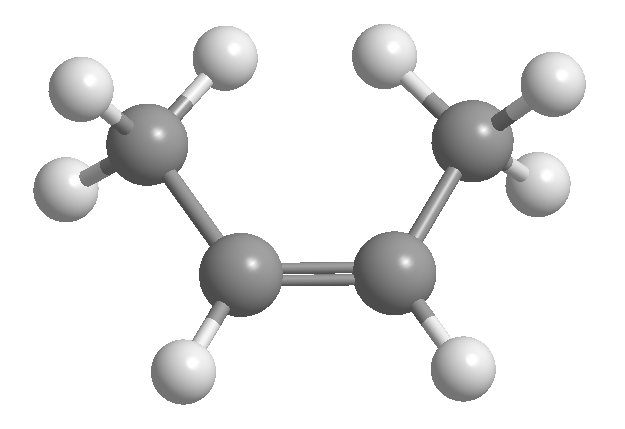
L'isomerismo cis-trans o geometrico è dovuto alla rotazione limitata attorno a un legame carbonio-carbonio. Questa restrizione può essere dovuta alla presenza di doppi legami o cicli. Pertanto, il 2-butene può esistere sotto forma di due isomeri, chiamati cis e trans. L'isomero con gli idrogeni dalla stessa parte si chiama cis, quello con le facce opposte si chiama trans.

[1] cis -2-Butene
[2] trans -2-Butene
I composti ciclici, a causa della loro rigidità, mostrano anche isomeria geometrica. Pertanto, l'1,2-dimetilcicloesano può esistere come due isomeri. Quello con gli idrogeni dalla stessa parte si chiama isomero cis e quello con gli idrogeni dalle parti opposte si chiama trans. 
[3] cis -1,2-Dimetilcicloesano
[4] trans -1,2-Dimetilcicloesano

[5] trans -2-Esene
[6] cis -2-Esene
![]() Si noti che la notazione cis/trans è scritta in corsivo minuscolo. Nella grafia il corsivo è sostituito dalla sottolineatura.
Si noti che la notazione cis/trans è scritta in corsivo minuscolo. Nella grafia il corsivo è sostituito dalla sottolineatura.