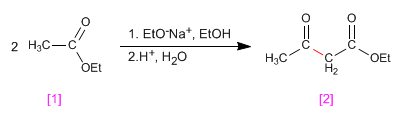TEORIA DI ESTERI
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 215472
Gli esteri derivano dalla condensazione di acidi con alcoli e sono denominati come sali dell'acido da cui provengono. La nomenclatura IUPAC cambia la desinenza -oico dell'acido in -oato , terminando con il nome del gruppo alchilico attaccato all'ossigeno.
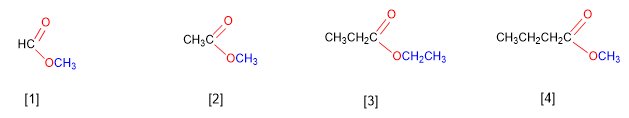
[1] Metanoato di metile (Formiato di metile)
[2] Etanoato di metile (Acetato di metile)
[3] Propanoato di etile
[4] Butanoato di metile
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 106685
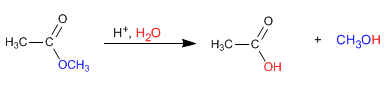
Gli esteri vengono idrolizzati in mezzi acquosi, sotto catalisi acida o basica, per produrre acidi carbossilici e alcoli.
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 111926
Gli esteri vengono idrolizzati in mezzi acquosi, sotto catalisi acida o basica, per produrre acidi carbossilici e alcoli. L'idrolisi basica si chiama saponificazione e trasforma gli esteri in carbossilati.
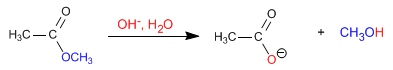
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 59473
I lattoni sono esteri ciclici e idrolizzano in modo analogo agli esteri non ciclici, formando composti contenenti gruppi acidi e alcolici.
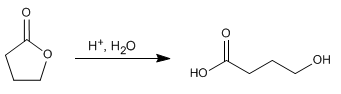
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 54176
Gli esteri reagiscono con gli alcoli in ambiente acido, sostituendo il loro gruppo alcossilico con il corrispondente alcol, come si può vedere nella seguente reazione. Questa reazione è chiamata transesterificazione.
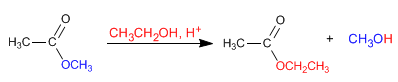
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 38164
Gli esteri transesterificano in presenza di alcossidi, a seconda della reazione:
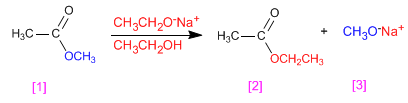
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 38060
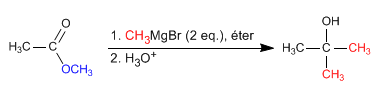
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 53200
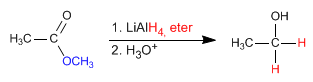
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 47932
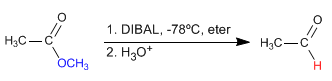
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 27590
Gli esteri hanno idrogeni acidi con pKa=25 nella loro posizione, che possono essere sottratti usando basi. La base coniugata è un estere enolato, una specie altamente nucleofila che attacca un numero vario di elettrofili.
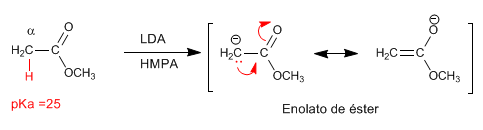
- Dettagli
- Germán Fernández
- TEORIA DI ESTERI
- Visite: 62264
Quando un estere con idrogeni a viene trattato con un equivalente di base (alcossido) condensa formando un prodotto della famiglia dei 3-chetoesteri. Questo tipo di reazione è noto come condensazione di Claisen.