THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 213799
Les aldéhydes sont nommés en remplaçant la terminaison -e de l'alcane correspondant par -al . Il n'est pas nécessaire de préciser la position du groupement aldéhyde, puisqu'il occupe l'extrémité de la chaîne (locant 1).
Lorsque la chaîne contient deux fonctions aldéhyde, le suffixe -dial est utilisé.
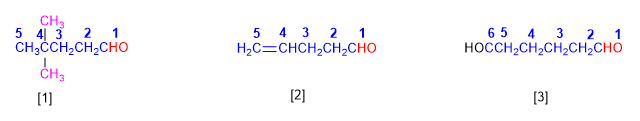
[1] 4,4-diméthylpentanal
[2] Pent-4-énal
[3] Hexanodial
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 142346
Les aldéhydes et les cétones peuvent être préparés par oxydation d'alcools, ozonolyse d'alcènes, hydratation d'alcynes et acylation de Friedel-Crafts comme méthodes principales.
a) Ozonolyse des alcènes : Les alcènes se décomposent avec l'ozone pour former des aldéhydes et/ou des cétones. Si l'alcène a des hydrogènes vinyliques, il donne des aldéhydes. S'il a deux chaînes carbonées, il forme des cétones. 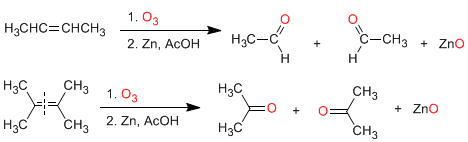
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 70554
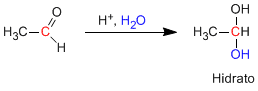
Les aldéhydes et les cétones réagissent en milieu aqueux acide pour former des hydrates. Le mécanisme se compose de trois étapes. La première et la plus rapide est la protonation de l'oxygène carbonyle. Cette protonation produit une augmentation de polarité sur le carbone et favorise l'attaque du nucléophile. Dans la deuxième étape, l'eau attaque le carbone carbonyle, c'est l'étape lente du mécanisme. Dans la troisième étape, la déprotonation de l'oxygène se produit, formant l'hydrate final.
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 91020
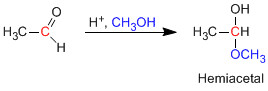
Les hémiacétals sont formés en faisant réagir un équivalent d'alcool avec le groupe carbonyle d'un aldéhyde ou d'une cétone. Cette réaction est catalysée par un acide et équivaut à la formation d'hydrates.
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 87663
Les aldéhydes et les cétones réagissent avec les alcools dans des conditions de catalyse acide, formant des hémiacétals dans un premier temps, qui évoluent ensuite par réaction avec un second équivalent d'alcool en acétals. 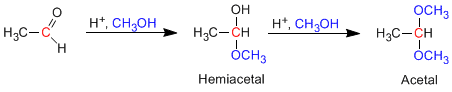
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 62857
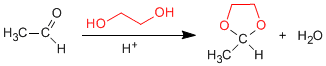
Les 1,2- et 1,3-diols réagissent avec les aldéhydes et les cétones pour former des acétals cycliques. Les équilibres sont déplacés vers le produit final en éliminant l'eau formée par azéotrope avec du benzène ou du toluène.
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 52637
 Les acétals peuvent être utilisés, en raison de leur stabilité, comme groupes protecteurs carbonyle. L'acétal est un éther, très stable en milieu basique, bien qu'il se brise en présence de milieu acide. Dans de nombreux procédés de synthèse, le groupement carbonyle est incompatible avec le réactif utilisé. Dans ces cas, il doit être protégé pour l'empêcher de réagir. L'instabilité de l'acétal en milieu acide peut être utilisée pour déprotéger le carbonyle.
Les acétals peuvent être utilisés, en raison de leur stabilité, comme groupes protecteurs carbonyle. L'acétal est un éther, très stable en milieu basique, bien qu'il se brise en présence de milieu acide. Dans de nombreux procédés de synthèse, le groupement carbonyle est incompatible avec le réactif utilisé. Dans ces cas, il doit être protégé pour l'empêcher de réagir. L'instabilité de l'acétal en milieu acide peut être utilisée pour déprotéger le carbonyle.
Voyons quelques exemples :
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 84153
La réaction des aldéhydes ou des cétones avec des amines primaires génère des imines . La réaction est favorisée en milieu légèrement acide (pH = 4,5). 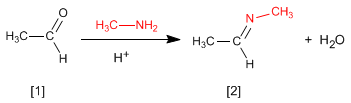
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 62709
Les oximes [3] sont obtenues par réaction d'aldéhydes ou de cétones [1] et d'hydroxylamine [2] en milieu faiblement acide. Le mécanisme est analogue à celui de la formation des imines. 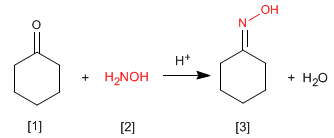
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 57914
Les hydrazones [3] sont obtenues en faisant réagir des aldéhydes ou des cétones [1] avec de l'hydrazine [2] . Comme dans le cas des imines et des oximes, il nécessite un pH=4.
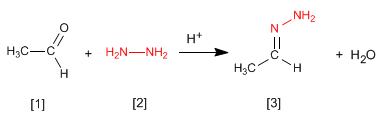
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 31761
L'hydrazine [2] réagit avec deux molécules d'aldéhyde [1] pour former des azines [3]. 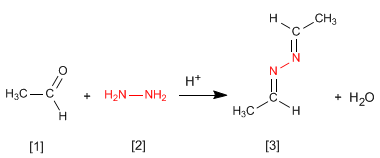
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 35847
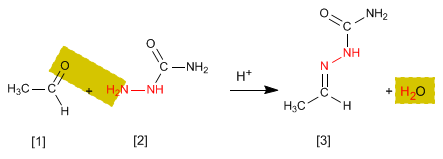
Les semicarbazones [3] sont obtenus en faisant réagir des aldéhydes ou des cétones [1] avec du semicarbazide [2] . Voyons un exemple :
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 88597
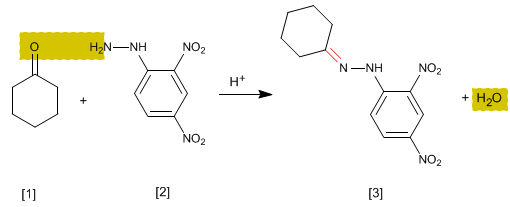
C'est un test analytique spécifique pour les aldéhydes et les cétones. Les carbonyles [1] réagissent avec la 2,4-dinitrophénylhydrazine [2] pour former des phénylhydrazones [3] qui précipitent en jaune. L'apparition d'un précipité est un indicateur de la présence de carbonyles dans le milieu.
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 38758
synthèse d'énamine
Comme nous l'avons vu dans les sections précédentes, la condensation des amines primaires avec les aldéhydes et les cétones génère des imines. Dans cette section, nous étudierons la condensation des carbonyles avec des amines secondaires qui donnent des énamines.
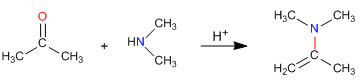
Mécanisme de formation d'énamine
Après l'attaque initiale de l'amine secondaire sur le carbonyle, l'eau est éliminée, formant la double liaison entre le carbone du carbonyle et l'alpha du carbonyle de départ.
Étape 1. Protonation du carbonyle
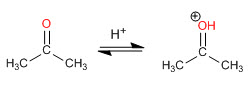
Étape 2. Attaque nucléophile de l'amine secondaire
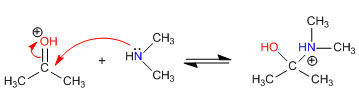
Étape 3. Équilibre acido-basique
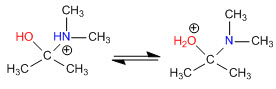
Étape 4. Perte d'eau
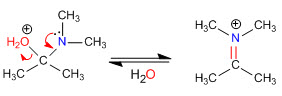
Étape 5. Élimination
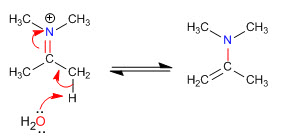
Les encombrements stériques font des énamines les moins substituées les plus stables
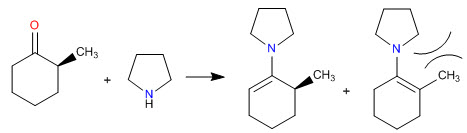
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 60088
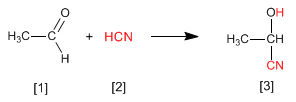
Les cyanohydrines [3] sont formées par la réaction d'aldéhydes ou de cétones [1] avec de l'acide cyanhydrique [2] et sont des composés qui contiennent un cyanane et un groupe hydroxy sur le même carbone.
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 68364
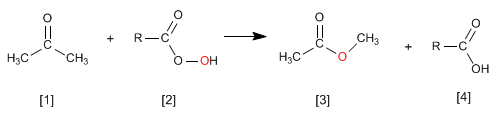
La réaction de Wittig utilise des ylures de phosphore [2] pour transformer des aldéhydes et des cétones [1] en alcènes [3] . L'oxyde de triphénylphosphine est obtenu comme sous-produit [4]. 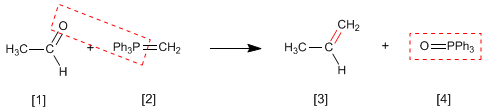
- Détails
- Germán Fernández
- THÉORIE DES ALDÉHYDES ET DES CÉTONES
- Affichages : 61309
La réaction des cétones [1] avec les peracides [2] produit des esters [3] . L'oxygène du peracide est inséré entre le carbone carbonyle et le carbone alpha de la cétone. Cette réaction a été décrite par Adolf von Baeyer et Victor Villiger en 1899.