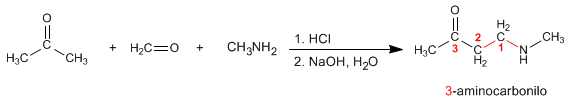TEORIA DELLE AMMINA
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 141342
Regola 1. Le ammine possono essere denominate derivati di alchilammine o alcanoammine. Vediamo alcuni esempi.
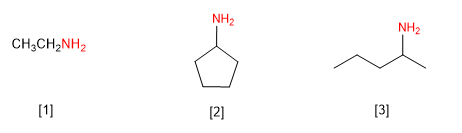
[1] Etilammina (etanamina)
[2] Ciclopentilammina (ciclopentanamina)
[3] (Pent-2-il)ammina (Pentan-2-ammina)
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 121611
Le ammine hanno punti di fusione e di ebollizione inferiori rispetto agli alcoli. Pertanto, l'etilamina bolle a 17ºC, mentre il punto di ebollizione dell'etanolo è 78ºC.
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 75620
Le ammine hanno idrogeni acidi sul gruppo amminico. Questi idrogeni possono essere sottratti utilizzando basi forti (organometalliche, idruri metallici) formando ammidi (basi amminiche).
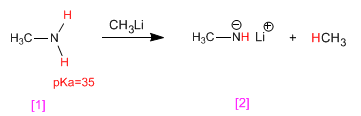
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 74838
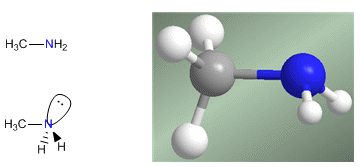
Le ammine sono composti azotati con una struttura piramidale, simile all'ammoniaca. L'azoto forma tre legami singoli attraverso orbitali ibridati sp 3 . La coppia solitaria occupa il quarto orbitale con ibridazione sp 3 ed è responsabile del comportamento di base e nucleofilo delle ammine.
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 58907
Le ammine possono essere preparate mediante reazioni di sostituzione nucleofila tra aloalcani e ammoniaca.
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 58256
I nitrili possono essere preparati facendo reagire gli aloalcani con il cianuro di sodio. La riduzione dei nitrili con LiAlH 4 produce ammine.
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 45318
La reazione di aloalcani primari e secondari con sodio azide produce alchilazidi, che per riduzione con LiAlH4 danno origine ad ammidi.
Leggi tutto: Preparazione di ammine mediante riduzione di azidi
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 45006
Le ammidi vengono ridotte con LiAlH4 per formare ammine. Il numero di atomi di carbonio dell'ammina finale è uguale a quello dell'ammide di partenza.
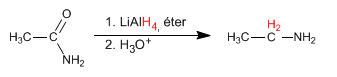
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 43149
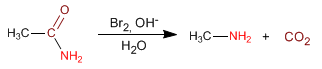
Leggi tutto: Sintesi delle ammine mediante riarrangiamento di Hofmann
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 60654
La sintesi di Gabriel consente di ottenere ammine primarie da aloalcani, senza la formazione di miscele di ammine secondarie e terziarie.
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 61938
L'amminazione riduttiva consiste nel formare un'immina, da aldeidi o chetoni e ammine, che viene ridotta ad ammina in uno stadio successivo. Questa riduzione può essere effettuata con $H_2$ catalizzata da Nichel o con $NaBH_3CN$.
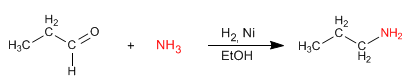
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 37429
Gli epossidi (ossaciclopropani) si aprono per attacco nucleofilo, a causa della significativa deformazione dell'anello. Se il nucleofilo utilizzato è l'ammoniaca, si ottiene un β-amminoalcol. Questo tipo di prodotto può essere ottenuto anche aprendo l'epossido con sodio azide e riducendo l'azide in un secondo tempo.
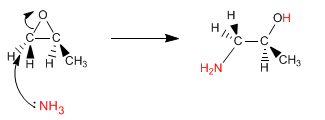
Leggi tutto: Sintesi di ammine mediante apertura di epossidi
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 66145
L'eliminazione di Hofmann consente la conversione delle ammine in alcheni. È una reazione regioselettiva che segue la regola di Hofmann, formando l'alchene meno sostituito.
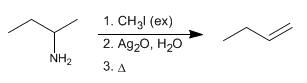
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 44941
L'eliminazione di Cope permette di ottenere alcheni da ammine terziarie. La reazione consiste nell'ossidare l'ammina terziaria, formando un N-ossido di ammina, che viene eliminato per via intramolecolare mediante riscaldamento, dando origine all'alchene.
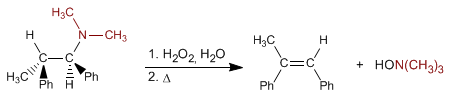
- Dettagli
- Germán Fernández
- TEORIA DELLE AMMINA
- Visite: 50943
Mannich prepara 3-amminocarbonili da ammine primarie o secondarie, metano e un carbonile enolizzabile. Vediamo un esempio: