TEORIA DEGLI ACIDI CARBOSSILICI
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 134104
IUPAC denomina gli acidi carbossilici sostituendo la desinenza -o dell'alcano con lo stesso numero di atomi di carbonio con -oico .
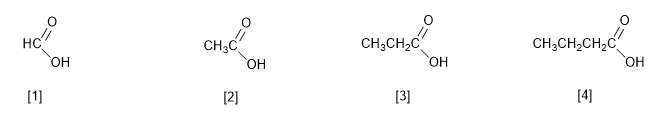
[1] Acido metanoico (acido formico)
[2] Acido etanoico (acido acetico)
[3] Acido propanoico (acido propionico)
[4] Acido butanoico (Acido butirrico)
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 114215
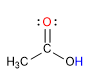
Gli acidi carbossilici sono molecole con geometria planare trigonale. Hanno idrogeno acido nel gruppo idrossile e si comportano come basi sull'ossigeno carbonilico.
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 86728
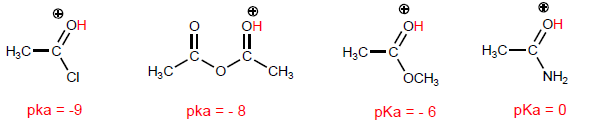
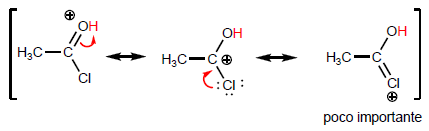
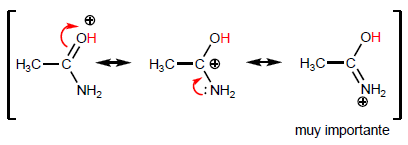
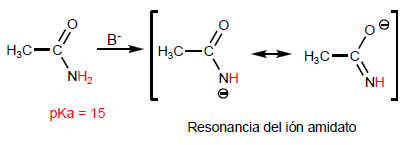
La proprietà più caratteristica degli acidi carbossilici è l'acidità dell'idrogeno situato sul gruppo idrossile. Il pKa di questo idrogeno varia da 4 a 5 a seconda della lunghezza della catena di carbonio.
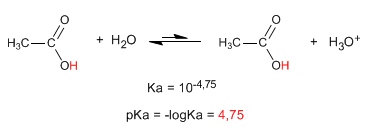
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 143006
Gli acidi carbossilici possono essere preparati utilizzando i seguenti metodi:
♦ Ossidazione di alchilbenzeni: Gli acidi carbossilici possono essere ottenuti da benzeni sostituiti con gruppi alchilici mediante ossidazione con permanganato di potassio o bicromato di sodio.
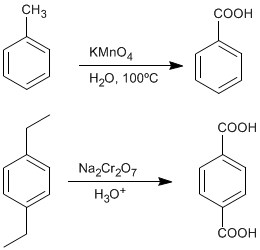
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 63365
Gli alogenuri alcanoilici si ottengono facendo reagire gli acidi carbossilici con PBr 3 . Si può usare anche SOCl 2 .
Pertanto, l'acido etanoico viene trasformato in etanoil bromuro per reazione con il tribromuro di fosforo. L'acido etanoico reagisce con il cloruro di tionile per formare il composto
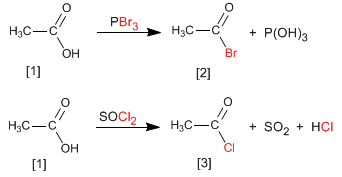
Leggi tutto: Sintesi di alogenuri alcanoilici da acidi carbossilici
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 75081
Le anidridi si ottengono per condensazione di acidi carbossilici con perdita di acqua. La reazione richiede un forte riscaldamento e un lungo tempo di reazione.
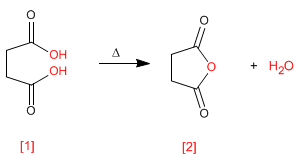
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 111093
Gli esteri si ottengono per reazione di acidi carbossilici e alcoli in presenza di acidi minerali. La reazione viene eseguita in eccesso di alcol per spostare gli equilibri a destra. La presenza di acqua è dannosa in quanto idrolizza l'estere formatosi.
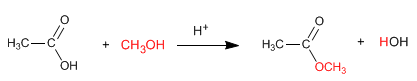
Leggi tutto: Sintesi di esteri da acidi carbossilici - Esterificazione
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 71078
I lattoni sono esteri ciclici ottenuti per esterificazione intramolecolare da molecole contenenti gruppi acidi e alcolici. Questa ciclizzazione forma cicli a 5 o 6 membri.
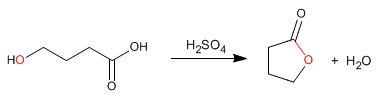
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 82270
Le ammidi sono formate dalla reazione di acidi carbossilici con ammoniaca, ammine primarie e secondarie. La reazione viene condotta sotto riscaldamento.
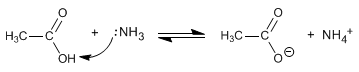
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 47975
I lattamici sono ammidi cicliche formate da molecole che contengono gruppi carbossilici e amminici. La reazione viene condotta mediante riscaldamento in assenza di acido.
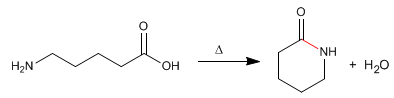
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 45436
Gli acidi carbossilici reagiscono con due equivalenti di organolitico seguito da idrolisi acquosa per formare chetoni.
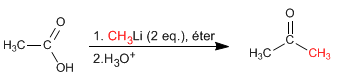
Leggi tutto: Reazione di acidi carbossilici con organometallici
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 69733
L'idruro di litio e alluminio riduce gli acidi carbossilici in alcoli.
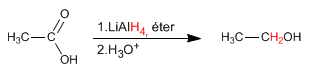
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 33045
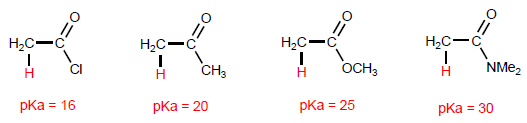
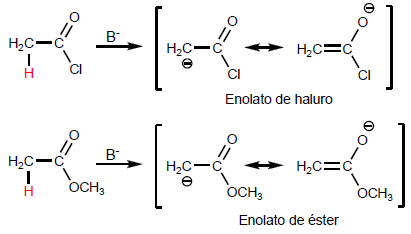
Gli a -idrogeno degli acidi carbossilici sono acidi e possono essere rimossi usando basi forti come LDA.
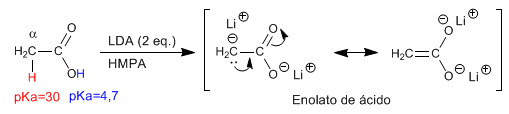
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 46651
La reazione di Hell-Volhard-Zelinsky rende possibile alogenare la posizione a degli acidi carbossilici. Il bromo catalizzato dal fosforo viene utilizzato come reagente. Il fosforo in presenza di bromo genera tribromuro di fosforo, che è appunto il composto che funge da catalizzatore.
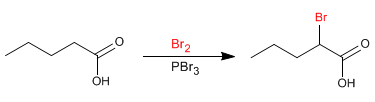
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 29878
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 33890
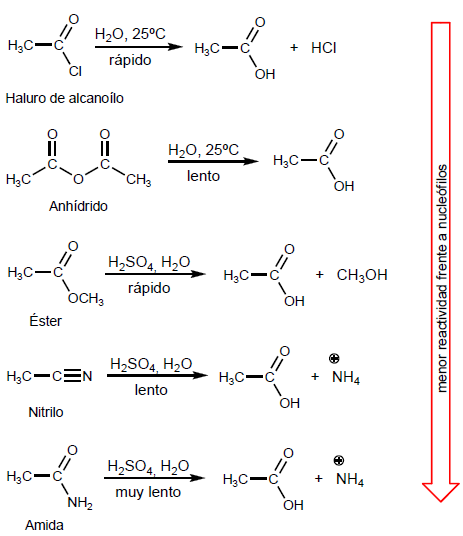
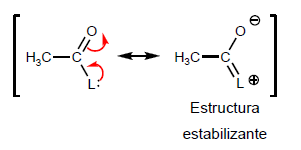
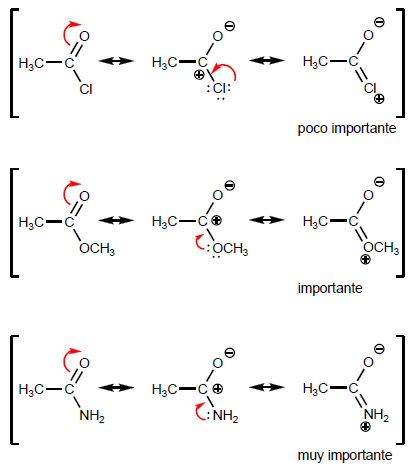
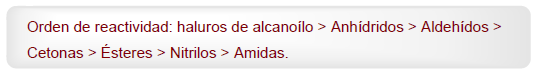
- Dettagli
- Germán Fernández
- TEORIA DEGLI ACIDI CARBOSSILICI
- Visite: 21525