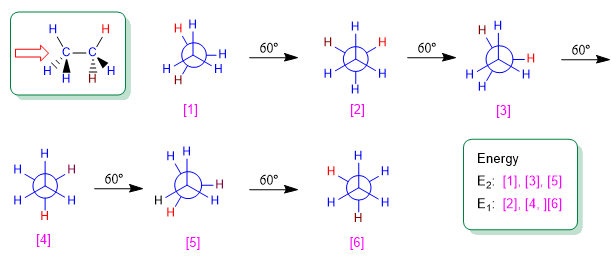
L'etano è l'alcano più semplice che può esistere in diverse conformazioni. Delle infinite conformazioni ottenibili ruotando il legame carbonio-carbonio, spiccano per importanza le conformazioni alternate ed eclissate.
Conformazione alternata dell'etano
Come si vede in figura, la conformazione alternata ha gli idrogeni del primo carbonio situati tra gli idrogeni del secondo carbonio, non ci sono idrogeni opposti. 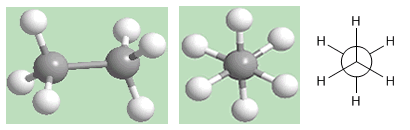
In questa conformazione, i legami carbonio-idrogeno di entrambi i carboni sono molto distanti, formando angoli di 60º. La conformazione sfalsata è la più stabile delle conformazioni dell'etano. Cioè, quello con l'energia più bassa.
Conformazione eclissata dell'etano
La seconda conformazione è detta eclissata. In esso, i legami carbonio-idrogeno di entrambi i carboni si fronteggiano (eclissati). I campi elettronici degli idrogeni opposti subiscono importanti repulsioni (eclisse) che ne destabilizzano la conformazione. La conformazione eclissata dell'etano è quella con la più alta energia. Cioè, il più instabile. 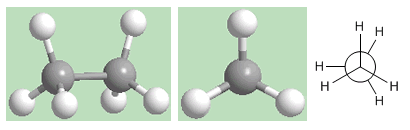
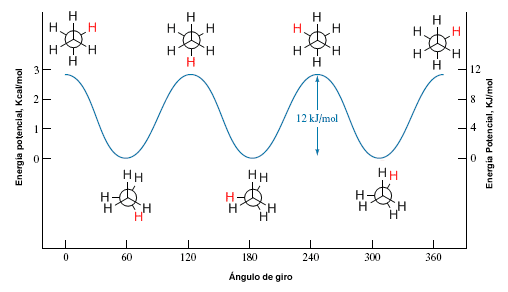
La rotazione attorno a un singolo legame carbonio-carbonio non è completamente libera, a causa delle differenze di energia tra le conformazioni sfalsate e quelle eclissate. Perché avvenga la rotazione è necessario superare una barriera energetica che è data dall'energia della conformazione eclissata (energia di attivazione). Nell'etano questa barriera energetica è piccola, circa 2,9 Kcal/mol (12 KJ/mol), e consente ai conformeri di interconvertirsi ad alta velocità.
Diagramma di energia potenziale
Un diagramma di energia potenziale ci permette di capire come cambia l'energia potenziale del sistema durante la rotazione. Questi diagrammi rappresentano l'energia potenziale della molecola contro l'angolo ruotato.