Le ammine hanno punti di fusione e di ebollizione inferiori rispetto agli alcoli. Pertanto, l'etilamina bolle a 17ºC, mentre il punto di ebollizione dell'etanolo è 78ºC.
CH3CH2OH P.eb. = 78ºC
CH3CH2NH2 P. eb. = 17ºC
La minore elettronegatività dell'azoto, rispetto a quella dell'ossigeno, rende i legami idrogeno formati dalle ammine più deboli di quelli formati dagli alcoli.
Si osserva inoltre che le ammine primarie hanno punti di ebollizione più alti di quelle secondarie e queste a loro volta più alte di quelle terziarie.
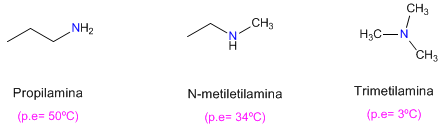
L'ammina terziaria non può formare legami idrogeno (manca di idrogeno su azoto), il che spiega il suo basso punto di ebollizione.
Nel caso dell'ammina secondaria, gli impedimenti sterici dovuti alle catene che circondano l'azoto ostacolano le interazioni tra le molecole.
Le ammine con meno di sette atomi di carbonio sono solubili in acqua.