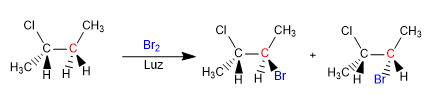
Vedremo come le reazioni chimiche possono introdurre chiralità nelle molecole, ottenendo prodotti sotto forma di miscele racemiche o miscele di diastereoisomeri.
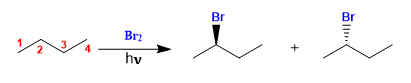
Il butano alogena in presenza di bromo e luce, al carbonio 2, per formare una miscela di enantiomeri. Il radicale formato presenta facce enantiotopiche, che si alogenano con uguale probabilità, dando origine ad una miscela racemica (enantiomeri in uguale proporzione).
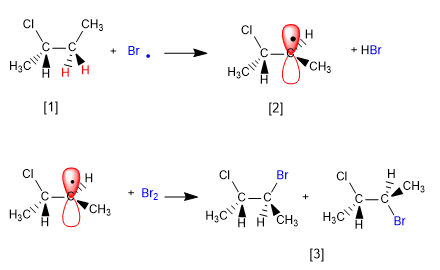
Il meccanismo di questa reazione è costituito da tre fasi: inizio, propagazione e terminazione. La propagazione è il passaggio che determina la stereochimica del prodotto finale.
Alogenazione del butano
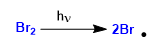
Fase 1. Iniziazione
Fase 2. Propagazione
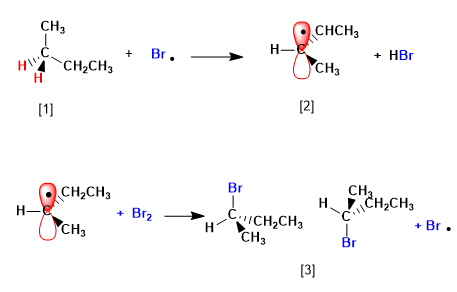
[1] H (idrogeno enantiotopico)
[2] Radicale con facce enantiotopiche
[3] Miscela di enantiomeri
Il prodotto si ottiene come miscela racemica, per la formazione di un radicale planare alogenato su entrambe le facce. Gli idrogeni enantiotopici sono chimicamente equivalenti e vengono sottratti dal bromo alla stessa velocità.