TEORIA DEI CICLOALCANI
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 1857
Nomenclatura dei cicloalcani 
I cicloalcani sono denominati con il prefisso ciclo- seguito dal nome dell'alcano con lo stesso numero di atomi di carbonio. I cicloalcani mostrano isomerismo cis/trans. Quando i sostituenti si trovano sulla stessa faccia della molecola, si dice che sono cis; quando si incontrano su lati opposti, si dice che sono trans.
Proprietà fisiche
Hanno punti di fusione e di ebollizione più alti rispetto ai corrispondenti alcani dello stesso numero di atomi di carbonio. La rigidità dell'anello consente un maggior numero di interazioni intermolecolari, che è necessario sfondare attraverso l'apporto di energia, per far passare le molecole alla fase gassosa.
Tensione anulare
I cicloalcani di piccole dimensioni (ciclopropano, ciclobutano) presentano uno stress significativo dovuto agli angoli di legame e all'eclisse. I cicloalcani più grandi come il ciclopentano e il cicloesano sono quasi privi di stress.
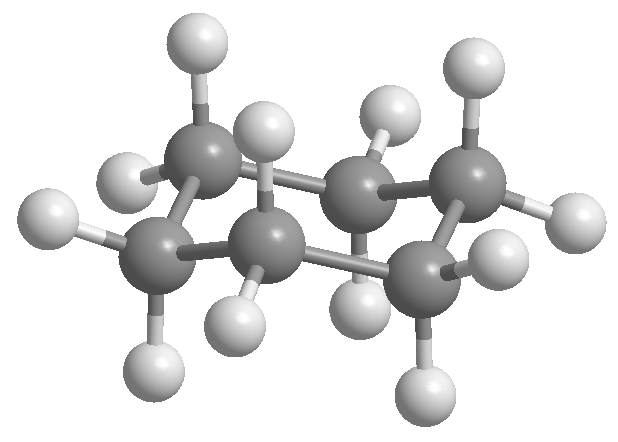
Isomeri conformazionali in cicloesano
Il cicloesano è disposto a forma di sedia per evitare l'eclissi tra gli idrogeni. La forma a sedia del cicloesano contiene due tipi di idrogeni; quelle assiali che si trovano perpendicolari al piano della molecola e quelle equatoriali poste sullo stesso piano.
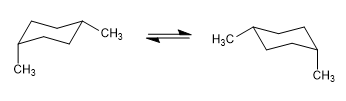
Equilibrio equatoriale-assiale in cicloesani sostituiti
Il cicloesano presenta un equilibrio conformazionale che interconverte gli idrogeni equatoriali in quelli assiali e viceversa. Quando si sostituisce un cicloesano, la conformazione che pone il maggior numero di gruppi in posizione equatoriale è la più stabile, trovando l'equilibrio conformazionale spostato verso tale conformazione.
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 166111
I cicloalcani sono alcani che hanno le estremità della catena unite insieme, formando un ciclo. Hanno due idrogeni in meno rispetto all'alcano da cui derivano, motivo per cui la loro formula molecolare è CnH2n . Sono denominati utilizzando il prefisso cyclo seguito dal nome dell'alcano.
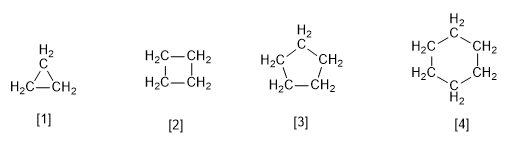
[1] Ciclopropano
[2] Ciclobutano
[3] Ciclopentano
[4] Cicloesano
È comune rappresentare le molecole indicando solo il loro scheletro. Ogni vertice rappresenta un carbonio legato a due idrogeni. 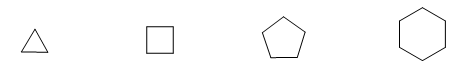
Le regole IUPAC per la denominazione dei cicloalcani sono molto simili a quelle studiate per gli alcani.
Regola 1.- Nei cicloalcani con un solo sostituente, il ciclo è considerato la catena principale della molecola. La numerazione dei cicli non è necessaria.
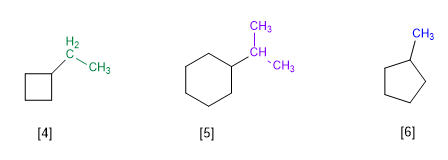
[4] Etilciclobutano
[5] Isopropilcicloesano
[6] Metilciclopentano
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 81768
In natura i composti con cicli di cinque e sei anelli sono molto abbondanti. Tuttavia, i cicli a tre e quattro membri compaiono molto raramente nei prodotti naturali.
Stabilità nei cicloalcani
Questi fatti sperimentali suggeriscono la maggiore stabilità dei cicli di cinque o sei membri rispetto a quelli di tre o quattro.
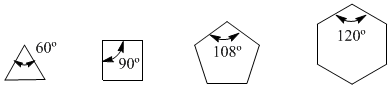
Nell'anno 1885, il chimico tedesco Adolf von Baeyer propose che l'instabilità dei piccoli cicli fosse dovuta alla tensione degli angoli di legame. I carboni sp3 hanno angoli di legame naturali di 109,5º, nel ciclopropano questi angoli sono di 60º, che è una deviazione di 49,5º. Questa deflessione si traduce in stress, che provoca instabilità nella molecola.
Il ciclobutano è più stabile poiché i suoi angoli di legame sono di 90º e la deflessione è di soli 19,5º. Baeyer ha applicato questo ragionamento agli altri cicloalcani e ha predetto che il ciclopentano dovrebbe essere più stabile del cicloesano.
Stress angolare
Osservare gli angoli di legame dei diversi cicloalcani:
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 70671
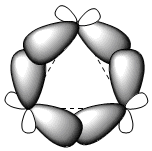 I tre atomi di carbonio del ciclopropano giacciono sullo stesso piano, a differenza degli altri cicloalcani che non sono planari. Il ciclopropano è caratterizzato da una grande deformazione angolare dovuta ad angoli di legame ben al di sotto di 109,5°. L'enorme stress a cui è sottoposto il ciclo fa piegare i legami carbonio-carbonio verso l'esterno, dando origine a legami molto caratteristici detti "a banana".
I tre atomi di carbonio del ciclopropano giacciono sullo stesso piano, a differenza degli altri cicloalcani che non sono planari. Il ciclopropano è caratterizzato da una grande deformazione angolare dovuta ad angoli di legame ben al di sotto di 109,5°. L'enorme stress a cui è sottoposto il ciclo fa piegare i legami carbonio-carbonio verso l'esterno, dando origine a legami molto caratteristici detti "a banana".
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 65463
Il ciclobutano non è piatto, uno dei suoi atomi di carbonio esce di circa 25º dal piano formato dagli altri tre atomi di carbonio. Questa disposizione aumenta la tensione angolare, ma l'eclisse idrogeno-idrogeno che la molecola presenta nella sua forma planare viene notevolmente ridotta.
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 52253
Se il ciclopentano fosse planare, sarebbe praticamente privo di deformazioni angolari. Ma presenterebbe cinque idrogeni eclissati per ogni faccia, il che destabilizzerebbe la molecola. La disposizione più favorevole del ciclopentano è la forma della busta. In questa disposizione la somma delle sollecitazioni angolari e dell'eclisse è minima.
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 73778
 I cicli di sei sono i più abbondanti in natura. Esistono molti composti con attività biologica la cui base sono cicli di sei atomi condensati (colesterolo).
I cicli di sei sono i più abbondanti in natura. Esistono molti composti con attività biologica la cui base sono cicli di sei atomi condensati (colesterolo).
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 74069
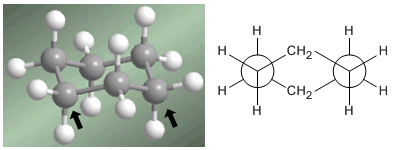
Il professor Odd Hassel dell'Università di Oslo ha stabilito che la conformazione più stabile del cicloesano è la forma a sedia. Con angoli di legame di 111º la sedia è quasi priva di tensione angolare. Inoltre, tutti i collegamenti sono sfalsati, come si può vedere nella proiezione di Newman.
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 3187
Il cicloesano presenta un equilibrio conformazionale in cui gli idrogeni assiali, in rosso, si spostano nella posizione equatoriale. Gli idrogeni equatoriali, in verde, girano in posizione assiale.
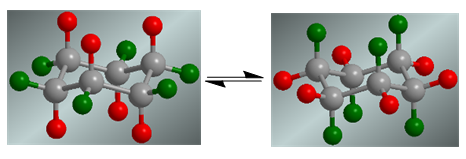
In assenza di sostituenti, entrambe le conformazioni hanno la stessa probabilità di esistere e l'equilibrio coformazionale non viene spostato.
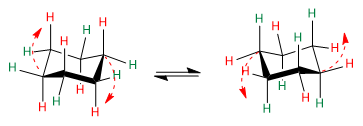
Osservare le frecce rosse per capire come avviene il passaggio da una conformazione all'altra.
- Dettagli
- Germán Fernández
- TEORIA DEI CICLOALCANI
- Visite: 6201
Nel modello seguente si può vedere che nel conformero equatoriale il gruppo metilico è lontano dal resto dei gruppi. Al contrario, nel conformero assiale detto gruppo metile è affacciato agli idrogeni assiali che si trovano in posizione 3 rispetto ad esso. Questa vicinanza spaziale provoca una repulsione sterica, chiamata interazione 1,3-diassiale.
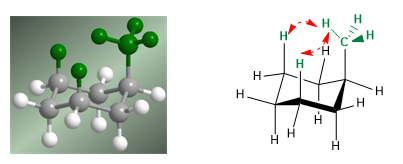
L'interazione 1,3-diassiale provoca uno spostamento dell'equilibrio conformazionale a sinistra. La conformazione a destra ha un'energia elevata dovuta alla repulsione tra metile e idrogeni assiali.
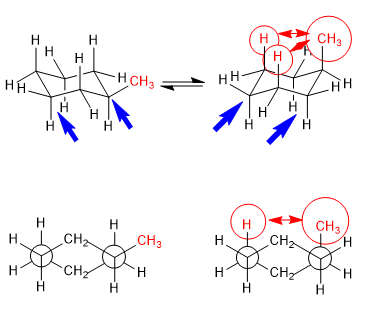
Equilibrio in trans-1,4-dimetilcicloesano
Le interazioni 1,3-diassiali fanno sì che i sostituenti tendano a trovarsi in posizioni equatoriali. Così, nel trans-1,4-Dimetilcicloesano la conformazione con i due gruppi metilici in equatoriale è più stabile della sedia con metili assiali, questo produce uno spostamento dell'equilibrio conformazionale verso sinistra.
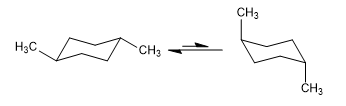
Equilibrio in cis-1,4-dimetilcicloesano