TEORIA DOS ALDEÍDOS E CETONAS
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 213043
Os aldeídos são nomeados substituindo a terminação -o do alcano correspondente por -al . Não é necessário especificar a posição do grupo aldeído, pois ele ocupa o final da cadeia (localizador 1).
Quando a string contém duas funções de aldeído, o sufixo -dial é usado.
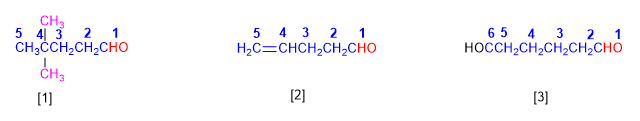
[1] 4,4-dimetilpentanal
[2] Pent-4-final
[3] Hexanodial
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 141954
Aldeídos e cetonas podem ser preparados por oxidação de álcoois, ozonólise de alcenos, hidratação de alcinos e acilação de Friedel-Crafts como principais métodos.
a) Ozonólise de alcenos: Os alcenos se decompõem com o ozônio para formar aldeídos e/ou cetonas. Se o alceno tiver hidrogênios vinílicos, ele fornecerá aldeídos. Se tiver duas cadeias de carbono forma cetonas. 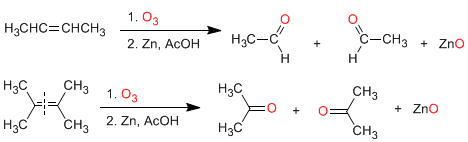
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 70041
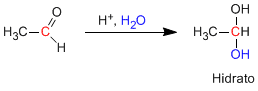
Aldeídos e cetonas reagem em um meio ácido aquoso para formar hidratos. O mecanismo consiste em três estágios. A primeira e mais rápida é a protonação do oxigênio da carbonila. Essa protonação produz um aumento da polaridade no carbono e favorece o ataque do nucleófilo. No segundo estágio, a água ataca o carbono carbonílico, é o estágio lento do mecanismo. Na terceira etapa, ocorre a desprotonação do oxigênio, formando o hidrato final.
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 91102
Os hemiacetais são formados pela reação de um equivalente de álcool com o grupo carbonila de um aldeído ou cetona. Esta reação é catalisada por ácido e é equivalente à formação de hidratos.
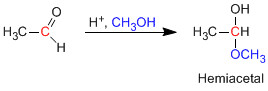
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 86666
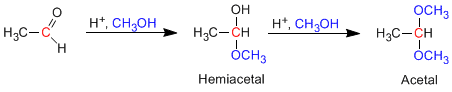
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 62126
1,2- e 1,3-dióis reagem com aldeídos e cetonas para formar acetais cíclicos. Os equilíbrios são deslocados em direção ao produto final pela remoção da água formada pela azeotropia com benzeno ou tolueno.
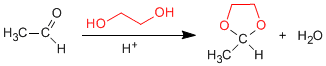
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 52146
 Os acetais podem ser usados, devido à sua estabilidade, como grupos protetores de carbonila. O acetal é um éter, muito estável em meios básicos, embora quebre na presença de meios ácidos. Em muitos processos de síntese, o grupo carbonila é incompatível com o reagente utilizado. Nestes casos, deve ser protegido para evitar que reaja. A instabilidade do acetal em meio ácido pode ser usada para desproteger a carbonila.
Os acetais podem ser usados, devido à sua estabilidade, como grupos protetores de carbonila. O acetal é um éter, muito estável em meios básicos, embora quebre na presença de meios ácidos. Em muitos processos de síntese, o grupo carbonila é incompatível com o reagente utilizado. Nestes casos, deve ser protegido para evitar que reaja. A instabilidade do acetal em meio ácido pode ser usada para desproteger a carbonila.
Vejamos alguns exemplos:
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 82207
A reação de aldeídos ou cetonas com aminas primárias gera iminas . A reação é favorecida em meio levemente ácido (pH=4,5). 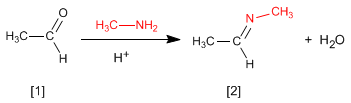
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 60267
As oximas [3] são obtidas pela reação de aldeídos ou cetonas [1] e hidroxilamina [2] em meio fracamente ácido. O mecanismo é análogo ao da formação de iminas. 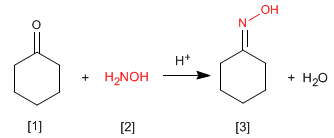
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 55846
Hidrazonas [3] são obtidas pela reação de aldeídos ou cetonas [1] com hidrazina [2] . Como no caso de iminas e oximas, requer pH=4.
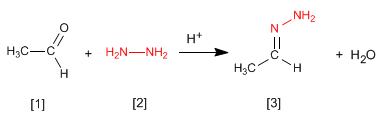
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 31125
A hidrazina [2] reage com duas moléculas de aldeído [1] para formar azinas [3]. 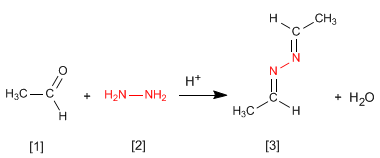
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 35297
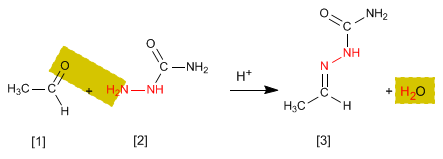
As semicarbazonas [3] são obtidas pela reação de aldeídos ou cetonas [1] com semicarbazida [2] . Vejamos um exemplo:
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 89220
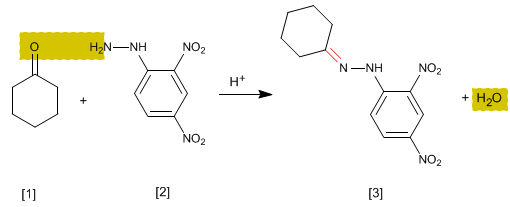
É um teste analítico específico para aldeídos e cetonas. Carbonilos [1] reagem com 2,4-Dinitrofenilhidrazina [2] para formar fenilhidrazonas [3] que precipitam amarelo. O aparecimento de um precipitado é um indicador da presença de carbonilos no meio.
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 39168
síntese de enamina
Como vimos nas seções anteriores, a condensação de aminas primárias com aldeídos e cetonas gera iminas. Nesta seção estudaremos a condensação de carbonilas com aminas secundárias que dão enaminas.
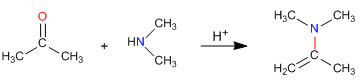
Mecanismo de formação de enamina
Após o ataque inicial da amina secundária à carbonila, a água é removida, formando a dupla ligação entre o carbono da carbonila e o alfa da carbonila de partida.
Etapa 1. Protonação da carbonila
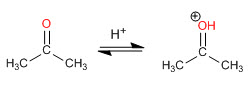
Etapa 2. Ataque nucleofílico da amina secundária
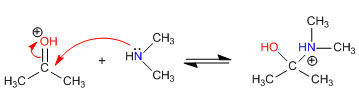
Estágio 3. Equilíbrio ácido-base
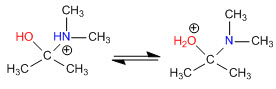
Estágio 4. Perda de água
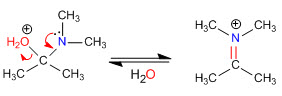
Fase 5. Eliminação
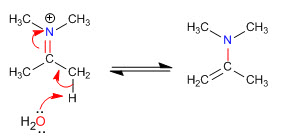
Os impedimentos estéricos tornam as enaminas menos substituídas as mais estáveis
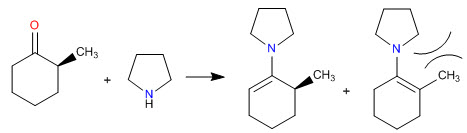
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 59522
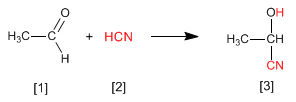
As cianoidrinas [3] são formadas pela reação de aldeídos ou cetonas [1] com o ácido cianídrico [2] e são compostos que contêm um grupo cinano e um grupo hidroxila no mesmo carbono.
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 67527
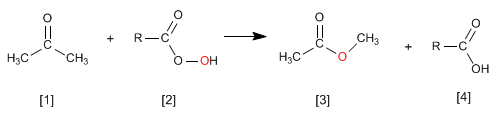
A reação de Wittig usa iletos de fósforo [2] para transformar aldeídos e cetonas [1] em alcenos [3] . O óxido de trifenilfosfina é obtido como subproduto [4]. 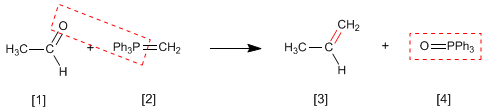
- Detalhes
- Germán Fernández
- TEORIA DOS ALDEÍDOS E CETONAS
- Acessos: 60223
A reação de cetonas [1] com perácidos [2] produz ésteres [3] . O oxigênio do perácido é inserido entre o carbono carbonílico e o carbono alfa da cetona. Esta reação foi descrita por Adolf von Baeyer e Victor Villiger em 1899.