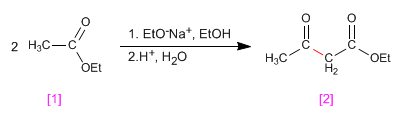THÉORIE DES ESTERS
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 214381
Les esters proviennent de la condensation d'acides avec des alcools et sont appelés sels de l'acide dont ils proviennent. La nomenclature IUPAC change la terminaison -oic de l'acide en -oate , se terminant par le nom du groupe alkyle attaché à l'oxygène.
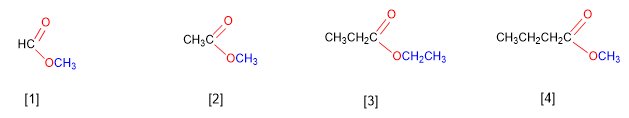
[1] Méthanoate de méthyle
[2] Éthanoate de méthyle
[3] Propanoate d'éthyle
[4] Butanoate de méthyle
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 105817
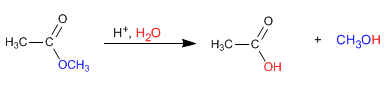
Les esters sont hydrolysés en milieu aqueux, sous catalyse acide ou basique, pour donner des acides carboxyliques et des alcools.
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 106617
Les esters sont hydrolysés en milieu aqueux, sous catalyse acide ou basique, pour donner des acides carboxyliques et des alcools. L'hydrolyse basique est appelée saponification et transforme les esters en carboxylates.
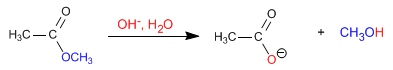
Lire la suite : Hydrolyse basique des esters. saponification
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 55719
Les lactones sont des esters cycliques et s'hydrolysent de manière analogue aux esters non cycliques, formant des composés contenant des groupes acides et alcools.
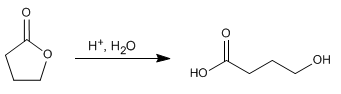
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 53093
Les esters réagissent avec les alcools en milieu acide, remplaçant leur groupe alcoxy par l'alcool correspondant, comme on peut le voir dans la réaction suivante. Cette réaction est appelée transestérification.
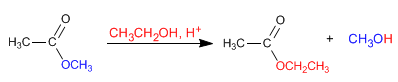
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 38346
Les esters se transestérifient en présence d'alcoolates, selon la réaction :
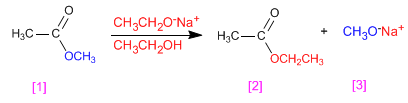
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 38178
Deux équivalents de magnésium organométallique s'ajoutent à l'ester, pour former des alcools tertiaires dans lesquels deux substituants sont identiques. Le mécanisme consiste en l'addition nucléophile de l'organométallique au carbonyle de l'ester. Après le premier ajout, il se forme une cétone qui est à nouveau attaquée par un deuxième équivalent de magnésium pour former l'alcool final.
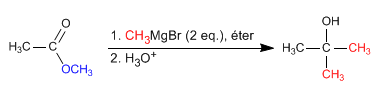
Lire la suite : Réaction des esters avec les organométalliques
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 55852
Les esters sont facilement réduits avec de l'hydrure de lithium et d'aluminium pour former des alcools primaires.
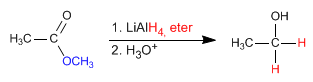
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 48893
Les esters sont réduits en aldéhydes avec de l'hydrure de diisobutylaluminium (DIBAL) à -78°C. Un seul équivalent doit être utilisé pour arrêter la réaction dans l'aldéhyde, en évitant sa réduction en alcool.
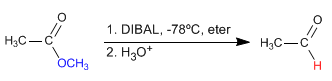
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 29163
Les esters ont des hydrogènes acides avec pKa = 25 dans leur position, qui peuvent être soustraits à l'aide de bases. La base conjuguée est un ester énolate, une espèce hautement nucléophile qui attaque un nombre varié d'électrophiles.
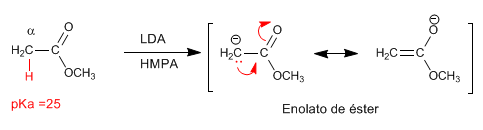
- Détails
- Germán Fernández
- THÉORIE DES ESTERS
- Affichages : 65054
Lorsqu'un ester avec des hydrogènes a est traité avec un équivalent de base (alcoolate), il se condense pour former un produit de la famille des 3-cétoesters. Ce type de réaction est connu sous le nom de condensation de Claisen.