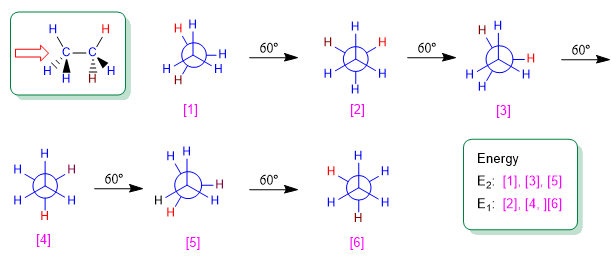
O etano é o alcano mais simples que pode existir em diferentes conformações. Das infinitas conformações que podem ser obtidas girando a ligação carbono-carbono, as conformações alternadas e eclipsadas se destacam por sua importância.
Conformação alternativa do etano
Como pode ser visto na figura, a conformação alternada tem os hidrogênios do primeiro carbono localizados entre os hidrogênios do segundo carbono, não há hidrogênios opostos. 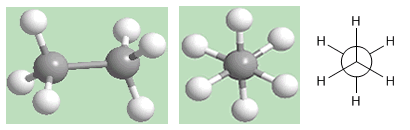
Nessa conformação, as ligações carbono-hidrogênio de ambos os carbonos estão distantes, formando ângulos de 60º. A conformação escalonada é a mais estável das conformações de etano. Ou seja, aquele com a menor energia.
Conformação eclipsada do etano
A segunda conformação é chamada eclipsada. Nela, as ligações carbono-hidrogênio de ambos os carbonos estão voltadas uma para a outra (eclipsadas). Os campos eletrônicos dos hidrogênios opostos sofrem importantes repulsões (eclipses) que desestabilizam a conformação. A conformação eclipsada do etano é a de maior energia. Ou seja, o mais instável. 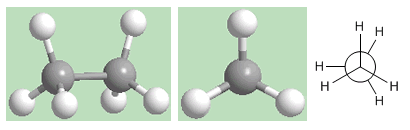
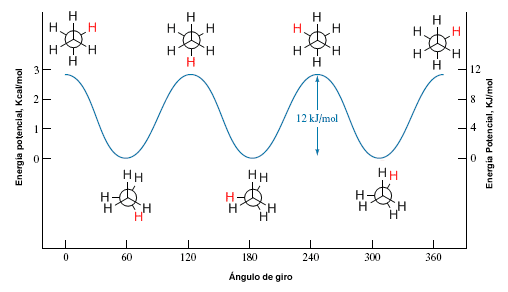
A rotação em torno de uma ligação simples carbono-carbono não é completamente livre, devido às diferenças de energia entre as conformações escalonada e eclipsada. Para que a rotação ocorra é necessário vencer uma barreira energética que é dada pela energia da conformação eclipsada (energia de ativação). No etano, essa barreira de energia é pequena, cerca de 2,9 Kcal/mol (12 KJ/mol), e permite que os confôrmeros se interconvertam em alta velocidade.
diagrama de energia potencial
Um diagrama de energia potencial nos permite entender como a energia potencial do sistema muda durante a rotação. Esses diagramas representam a energia potencial da molécula contra o ângulo girado.