TEORIA DA ESTEREOQUÍMICA
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 1917
definição de isômero
Moléculas que possuem a mesma fórmula molecular, mas estruturas diferentes são chamadas de isômeros. É classificado como isômeros estruturais e estereoisômeros.
isômeros estruturais
Os isômeros estruturais diferem na maneira como os átomos são unidos e, por sua vez, são classificados em isômeros de cadeia posicionais e funcionais.
estereoisômeros
Os estereoisômeros têm todas as ligações idênticas e são diferenciados pelo arranjo espacial dos grupos. Eles são classificados como cis-trans ou isômeros geométricos, enantiômeros e diastereoisômeros.
centro quiral ou assimétrico
Um átomo ligado a quatro substituintes diferentes é chamado de centro quiral ou assimétrico. Uma molécula que tem um centro quiral tem uma imagem especular não sobreponível dela, chamada de enantiômero.
atividade óptica
Os enantiômeros têm quase todas as propriedades físicas idênticas, com exceção da atividade óptica. Um dos enantiômeros gira a luz polarizada para a direita (destro) e o outro gira a luz polarizada para a esquerda (canhoto).
estereoquímica em reações
As reações de halogenação radical em moléculas nas quais centros quirais podem ser formados produzem misturas de enantiômeros em quantidades iguais ou de diastereoisômeros em proporções diferentes.
separação de enantiômeros
Os enantiômeros têm quase todas as mesmas propriedades físicas, diferem na luz polarizada por rotação, mas têm os mesmos pontos de fusão e ebulição e solubilidade idêntica. Portanto, não podemos aplicar os métodos tradicionais de separação e devemos recorrer a técnicas especiais. A separação via diastereoisômeros, consiste em transformar a mistura de enantiômeros em uma mistura de diastereoisômeros pela adição de um reagente quiral, os diastereoisômeros são facilmente separados por métodos físicos.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 110466
Estereoquímica é o estudo de compostos orgânicos no espaço. Para compreender as propriedades dos compostos orgânicos é necessário considerar todas as três dimensões espaciais. 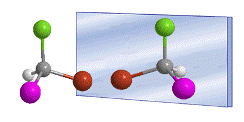 As bases da estereoquímica foram lançadas por Jacobus van't Hoff e Le Bel, em 1874. Eles propuseram independentemente que os quatro substituintes de um carbono são direcionados para os vértices de um tetraedro, com o carbono no centro do tetraedro.
As bases da estereoquímica foram lançadas por Jacobus van't Hoff e Le Bel, em 1874. Eles propuseram independentemente que os quatro substituintes de um carbono são direcionados para os vértices de um tetraedro, com o carbono no centro do tetraedro.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 292892
Isômeros são moléculas que possuem a mesma fórmula molecular, mas estruturas diferentes. É classificado como isômeros estruturais e estereoisômeros. Os isômeros estruturais diferem na maneira como seus átomos estão ligados e são classificados em isômeros de cadeia, posição e função. Como exemplo, vamos desenhar os isômeros estruturais de fórmula C 2 H 6 O .

[1] Etanol
[2] Éter dimetílico
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 263362
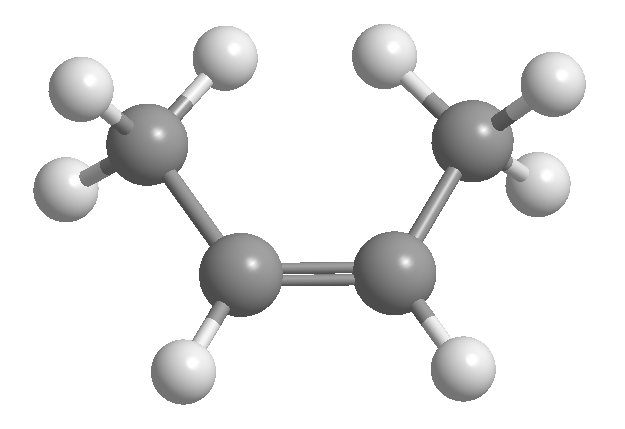
Cis-trans ou isomerismo geométrico é devido à rotação restrita em torno de uma ligação carbono-carbono. Essa restrição pode ser devida à presença de ligações duplas ou ciclos. Assim, o 2-buteno pode existir na forma de dois isômeros, chamados cis e trans. O isômero com os hidrogênios do mesmo lado é chamado de cis, e aquele com os lados opostos é chamado de trans.

[1] cis -2-buteno
[2] trans -2-buteno
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 159870
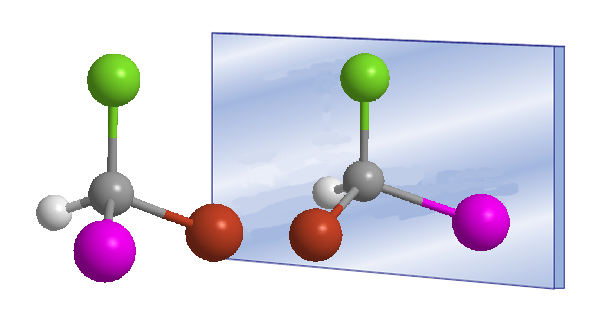
A palavra quiral foi introduzida por William Thomson (Lord Kelvin) em 1894 para designar objetos que não são sobreponíveis com sua imagem especular. Aplicado à química orgânica, podemos dizer que uma molécula é quiral quando ela e sua imagem especular não são sobreponíveis.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 107364
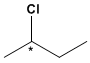 Compostos com um carbono assimétrico, como o 2-clorobutano, podem existir como dois isômeros.
Compostos com um carbono assimétrico, como o 2-clorobutano, podem existir como dois isômeros.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 4005
O número máximo de estereoisômeros que uma molécula apresenta pode ser calculado com a fórmula (2 n ), onde n representa o número de carbonos assimétricos. Assim, uma molécula com 2 centros quirais possui 4 estereoisômeros.
Exemplo 1. Desenhe os possíveis estereoisômeros de 2-Bromo-3-clorobutano.
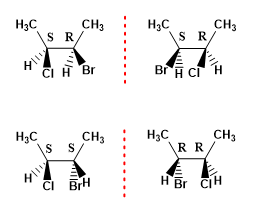
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 130104
É necessária uma nomenclatura que distinga os estereoisômeros de uma molécula. Assim, no caso do 2-clorobutano, a notação deve distinguir um enantiômero do outro. Cahn, Ingold e Prelog desenvolveram algumas regras que nos permitem distinguir alguns estereoisômeros de outros, que descrevo a seguir.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 98326
As moléculas que têm um plano de simetria ou um centro de inversão são superponíveis com sua imagem especular. Dizem que são moléculas aquirais.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 135261
A atividade óptica é a capacidade de uma substância quiral de girar o plano da luz polarizada. É medido usando um dispositivo chamado polarímetro.
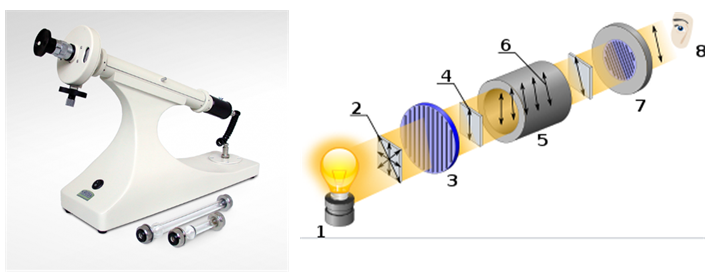
[1] Fonte de luz
[2] Luz não polarizada
[3] Polarizador linear
[4] Luz linearmente polarizada
[5] Cubeta de amostra
[6] Rotação em luz polarizada
[7] Analisador
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 155737
Projetar consiste em desenhar uma molécula em duas dimensões (plano). Na projeção de Fischer, a molécula é desenhada em forma de cruz com os substituintes que vão para o fundo do plano na vertical e os grupos que saem em nossa direção na horizontal, o ponto de interseção de ambas as linhas representa o carbono projetado.
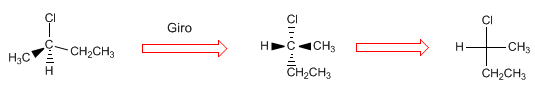
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 96208
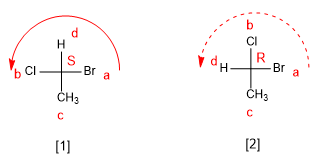
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 93280
Para converter projeções de Newman em projeções de Fischer, a forma espacial da molécula é desenhada, arranjando-a em uma conformação eclipsada para fazer a projeção de Fischer.
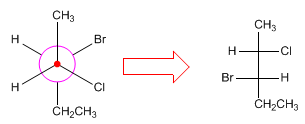
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 93937
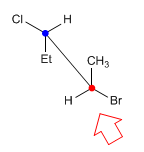 Na projeção de cavalete (também chamada de perspectiva) a linha de observação faz um ângulo de 45º com a ligação carbono-carbono. O carbono mais próximo do observador está abaixo e à direita. Enquanto o mais distante está no canto superior esquerdo.
Na projeção de cavalete (também chamada de perspectiva) a linha de observação faz um ângulo de 45º com a ligação carbono-carbono. O carbono mais próximo do observador está abaixo e à direita. Enquanto o mais distante está no canto superior esquerdo.
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 4267
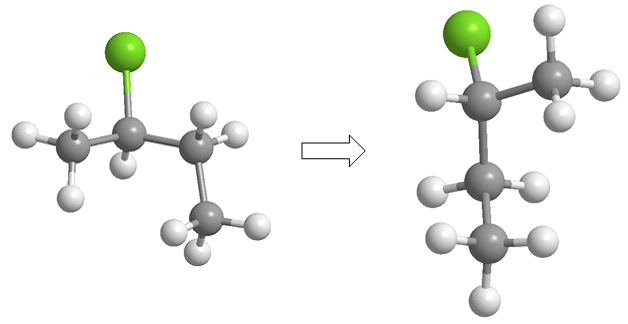
Veremos como as reações químicas podem introduzir quiralidade nas moléculas, obtendo produtos na forma de misturas racêmicas ou misturas de diastereoisômeros.
O butano halogena na presença de bromo e luz, no carbono 2, para formar uma mistura de enantiômeros. O radical formado apresenta faces enantiotópicas, que são halogenadas com igual probabilidade, dando origem a uma mistura racêmica (enantiômeros em igual proporção).
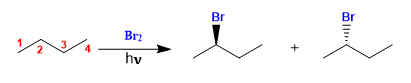
O mecanismo desta reação consiste em três etapas: iniciação, propagação e terminação. A propagação é a etapa que determina a estereoquímica do produto final.
halogenação de butano
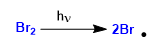
Estágio 1. Iniciação
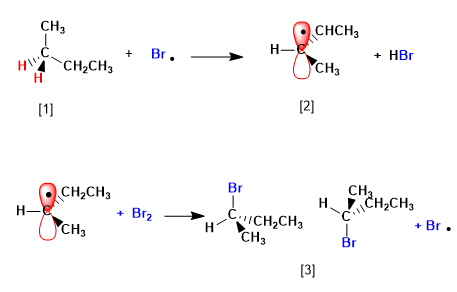
Estágio 2. Propagação
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 5748
reação estereosseletiva
- Detalhes
- Germán Fernández
- TEORIA DA ESTEREOQUÍMICA
- Acessos: 4774
Dificuldades em separar racematos