TEORIA DO BENZENO
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 152346
Os benzenos monossubstituídos são nomeados pela terminação do nome do substituinte em benzeno.
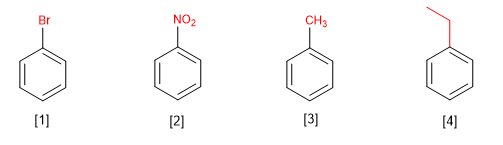
[1] Bromobenzeno
[2] Nitrobenzeno
[3] Metilbenzeno (tolueno)
[4] Etilbenzeno
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 87313
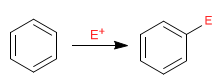
O benzeno atua como um nucleófilo, atacando um grande e variado número de eletrófilos.
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 126293
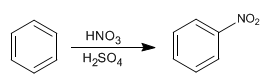
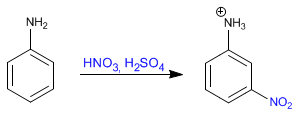
O benzeno reage com a mistura nítrico-sulfúrica adicionando grupos nitro.
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 117061
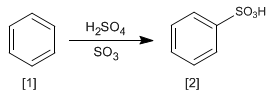
A reação do benzeno [1] com uma solução de trióxido de enxofre em ácido sulfúrico produz ácidos benzenossulfônicos [2].
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 102218
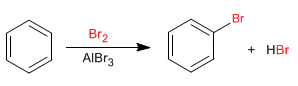
O benzeno reage com halogênios na presença de ácidos de Lewis para formar derivados halogenados.
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 74018
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3200
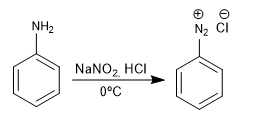
O grupo amino é introduzido no anel aromático por redução do nitro.
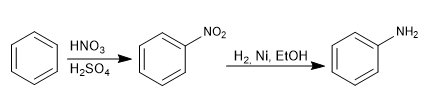
Os reagentes usados na redução podem ser:
- Sn, HCl
- H2 , Ni, EtOH
- Fe, HCl
Ler mais: Redução de nitro a amino e oxidação de amino a nitro
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 2863
A reversibilidade da sulfonação permite que ela seja usada para proteger as posições ativadas do benzeno. Vejamos um exemplo:
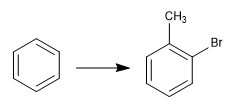
Para obter o-bromotolueno, realizamos as seguintes etapas:
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 4127
A reação do 1-cloro-2,4-dinitrobenzeno com nucleófilos (hidróxido, amônia, metóxido, etc.) produz a substituição do cloro pelo nucleófilo correspondente. É chamado de ipso (mesmo lugar), para indicar que o nucleófilo ocupa a mesma posição que o cloro inicial.
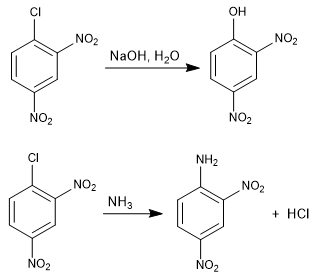
Ler mais: Substituição nucleofílica aromática por adição-eliminação
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 55416
Os benzenos halogenados reagem com soda diluída sob condições de alta pressão e temperatura para formar fenóis. Esta reação não requer grupos desativantes na posição orto/para e segue um mecanismo diferente da substituição nucleofílica aromática por adição-eliminação.
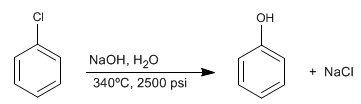
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3483
O carbono ligado diretamente ao benzeno é conhecido como posição benzílica. Nesta posição, carbocátions, carbânions e radicais altamente estáveis são formados devido à possibilidade de deslocamento da carga no anel aromático.
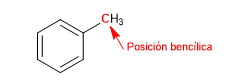
S N 1 em posições benzílicas
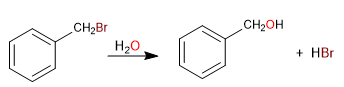
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3998
Oxidação em cadeia com permanganato e dicromato
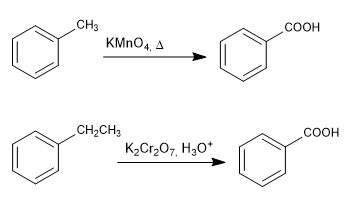
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3962
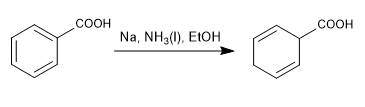
A redução de Birch usa sódio ou lítio em solução como reagentes, seu mecanismo é radical e reduz o benzeno a 1,4-ciclohexadieno.
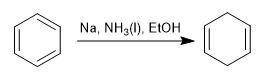
Bétula com substituintes ativadores
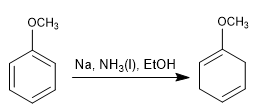
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3089
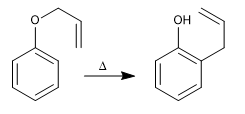
Os éteres alílicos fenílicos sofrem uma reação combinada quando aquecidos, envolvendo o movimento de seis elétrons, chamado de rearranjo de Claisen. O intermediário formado na reação é de alta energia e rapidamente tautomeriza para dar o produto final.
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 3449
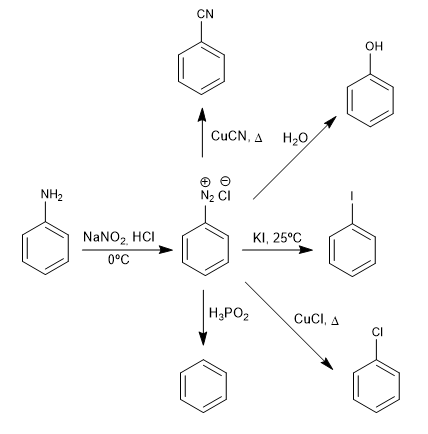
Os sais de benzenodiazônio são atacados por nucleófilos na presença de sais de cobre (I) que atuam como catalisadores, obtendo uma grande variedade de produtos.
- Detalhes
- Germán Fernández
- TEORIA DO BENZENO
- Acessos: 4219
Formação de compostos azo