As aminas possuem hidrogênios ácidos no grupo amino. Esses hidrogênios podem ser subtraídos usando bases fortes (organometálicos, hidretos metálicos) formando amidas (bases amina).
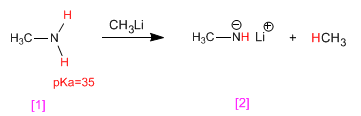
A metilamina [1] reage com o metil-lítio, transformando-se em sua base conjugada, a metilamida de lítio [2] . Por sua vez, o metil-lítio é transformado em seu ácido conjugado, o metano.
A desprotonação da diisopropilamina produz uma das bases mais utilizadas na química orgânica, a diisopropilamida de lítio (LDA).
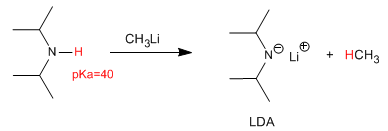
No entanto, o comportamento mais importante das aminas é básico. As aminas são as substâncias orgânicas neutras mais básicas.
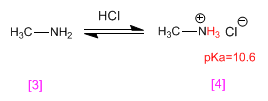
A metilamina [3] é protonada para se tornar cloreto de metilamônia (sal de amônio) [4] . Os sais de amônio são os ácidos conjugados das aminas e possuem pKas variando de 9 a 11.
A basicidade das aminas depende dos efeitos indutivos e estéricos. Assim, o pKa aumenta com o comprimento da cadeia carbônica (efeito indutivo).
CH3NH2 pKa = 10,6
CH 3 CH 2 NH 2 pKa = 10,8
(CH 3 ) 3 CNH 2 pKa=10,4
A cadeia carbônica dá carga ao grupo amino, por efeito indutivo, aumentando sua basicidade. A base forte tem um ácido conjugado fraco, então o pKa sobe. Mas se a cadeia for muito volumosa, os efeitos estéricos começam a predominar, causando uma diminuição do pKa.