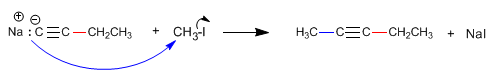
Como vimos no ponto anterior, os alcinos terminais possuem hidrogénios ácidos que podem ser removidos por bases fortes, formando acetiletos (base conjugada do alcino). Os acetilídeos são bons nucleófilos e fornecem mecanismos de substituição nucleofílica com substratos primários.
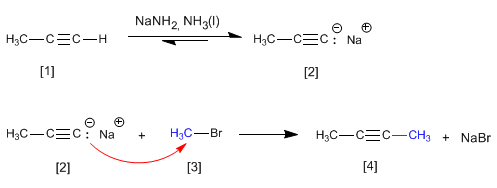
Propino reage com amida de sódio em amônia líquida para formar propinil sódico. Na segunda etapa, o propinil de sódio ataca o brometo de metila como um nucleófilo para formar 2-butino. Nessa reação, o alcino é alquilado, formando uma ligação carbono-carbono que aumenta o tamanho da cadeia carbônica.
A formação de ligações carbono-carbono é de grande importância na síntese orgânica, permitindo a construção de moléculas grandes a partir de moléculas menores.
A reação de alquilação só pode ser realizada com haloalcanos primários. Assim, brometo de isopropila (substrato secundário) gera propeno por reação com propinil sódico, através do mecanismo E2.
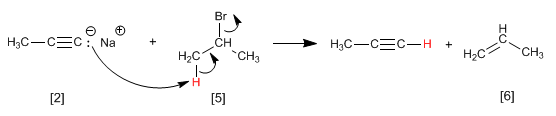
Exemplo: Obter 2-pentina a partir do acetileno
Etapa 1. Desprotonação do acetileno com amida de sódio
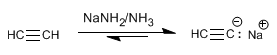
Etapa 2. Alquilação com iodeto de etila
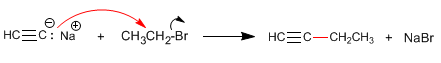
Etapa 3. Desprotonação de 1-butino
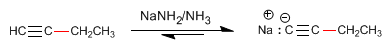
Etapa 4. Alquilação de 1-butinil sódico com iodeto de metila