Alcanos são compostos com hibridação sp 3 em todos os carbonos. Os quatro substituintes que partem de cada carbono estão dispostos em direção aos vértices de um tetraedro.
As distâncias e os ângulos de ligação são mostrados nos seguintes modelos. 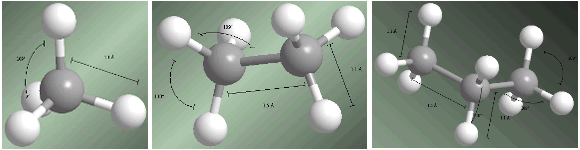
Os alcanos menores, metano, etano, propano e butano, são gases à temperatura ambiente. Alcanos lineares de C 5 H 12 a C 17 H 36 são líquidos. alcanos de  maior número de carbonos são sólidos à temperatura ambiente.
maior número de carbonos são sólidos à temperatura ambiente.
Os pontos de fusão e ebulição dos alcanos aumentam com o número de carbonos na molécula. Também é observado que os alcanos ramificados têm um ponto de ebulição menor do que seus isômeros lineares.
O gráfico a seguir mostra os pontos de ebulição dos alcanos lineares (em preto) e os correspondentes aos seus isômeros 2-metilalcanos (em azul). 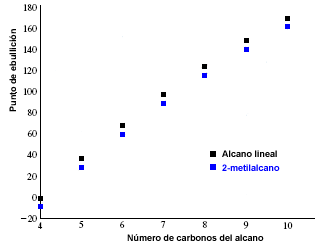
Na fase líquida existem forças de atração entre as moléculas que as mantêm unidas. Para passar a substância para a fase gasosa, é necessário vencer essas forças intermoleculares por meio da entrada de energia. 
Em moléculas neutras, como os alcanos, as forças atrativas são devidas a interações de van der Waals que podem ser de três tipos: dipolo-dipolo, dipolo induzido por dipolo e interações dipolo induzida por dipolo induzido.
A formação de dipolos induzidos que produzem a atração entre moléculas neutras pode ser observada no seguinte esquema: 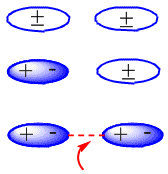
Consideremos os isômeros do pentano, como exemplo da diminuição do ponto de ebulição, ao passar de alcanos lineares para ramificados.
O pentano tem uma grande área de superfície que permite um grande número de interações dipolo-dipolo induzido. O 2-metilbutano é mais compacto e tem uma área de superfície menor, menos interações intermoleculares e um ponto de ebulição mais baixo.