TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 135456
A IUPAC nomeia os ácidos carboxílicos substituindo a terminação -o do alcano pelo mesmo número de carbonos por -oico .
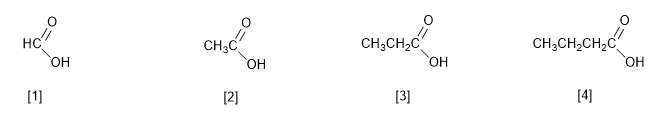
[1] Ácido metanoico (ácido fórmico)
[2] Ácido etanóico (ácido acético)
[3] Ácido propanoico (ácido propiônico)
[4] Ácido butanóico (ácido butírico)
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 118197
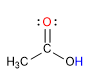
Os ácidos carboxílicos são moléculas com geometria planar trigonal. Eles têm hidrogênio ácido no grupo hidroxila e se comportam como bases no oxigênio carbonílico.
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 87605
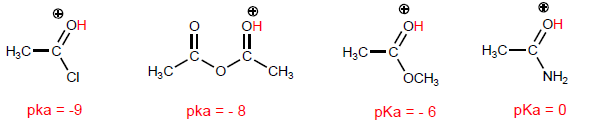
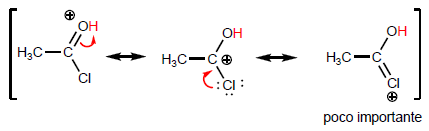
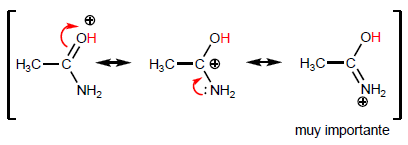
A propriedade mais característica dos ácidos carboxílicos é a acidez do hidrogênio localizado no grupo hidroxila. O pKa deste hidrogênio varia de 4 a 5, dependendo do comprimento da cadeia de carbono.
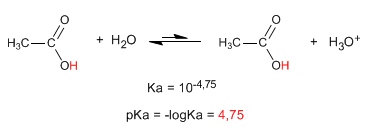
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 142748
Os ácidos carboxílicos podem ser preparados usando os seguintes métodos:
♦ Oxidação de alquilbenzenos: Ácidos carboxílicos podem ser obtidos a partir de benzenos substituídos por grupos alquil por oxidação com permanganato de potássio ou dicromato de sódio.
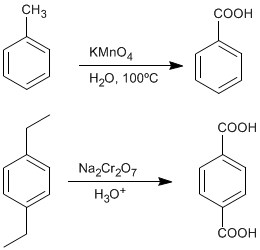
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 62863
Haletos de alcanoíla são obtidos pela reação de ácidos carboxílicos com PBr 3 . SOCl2 também pode ser usado.
Assim, o ácido etanóico é transformado em brometo de etanol por reação com o tribrometo de fósforo. O ácido etanóico reage com o cloreto de tionila para formar o composto
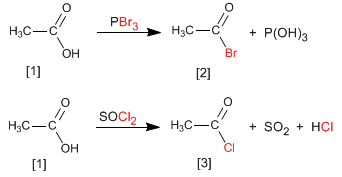
Ler mais: Síntese de haletos de alcanoíla a partir de ácidos carboxílicos
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 72973
Os anidridos são obtidos pela condensação de ácidos carboxílicos com perda de água. A reação requer forte aquecimento e um longo tempo de reação.
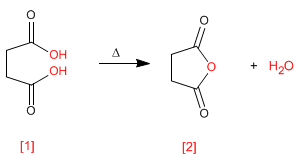
Ler mais: Síntese de anidridos a partir de ácidos carboxílicos
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 111920
Os ésteres são obtidos pela reação de ácidos carboxílicos e álcoois na presença de ácidos minerais. A reação é realizada em excesso de álcool para deslocar o equilíbrio para a direita. A presença de água é prejudicial, pois hidrolisa o éster formado.
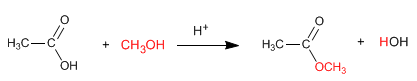
Ler mais: Síntese de ésteres a partir de ácidos carboxílicos - Esterificação
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 70186
As lactonas são ésteres cíclicos obtidos por esterificação intramolecular a partir de moléculas contendo grupos ácidos e álcool. Esta ciclização forma ciclos de 5 ou 6 membros.
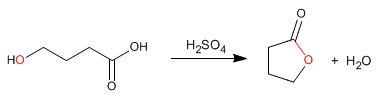
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 78417
As amidas são formadas pela reação de ácidos carboxílicos com amônia, aminas primárias e secundárias. A reação é realizada sob aquecimento.
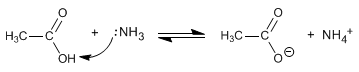
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 47279
Os lactâmicos são amidas cíclicas formadas a partir de moléculas que contêm grupos carboxílicos e amina. A reação é realizada por aquecimento na ausência de ácido.
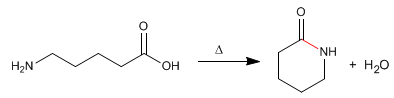
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 44897
Ácidos carboxílicos reagem com dois equivalentes de organolítico seguido de hidrólise aquosa para formar cetonas.
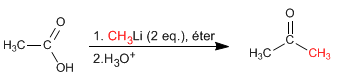
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 65929
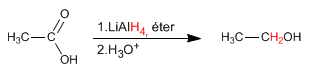
O hidreto de alumínio e lítio reduz os ácidos carboxílicos a álcoois.
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 32558
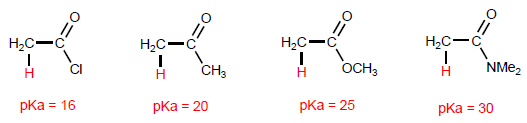
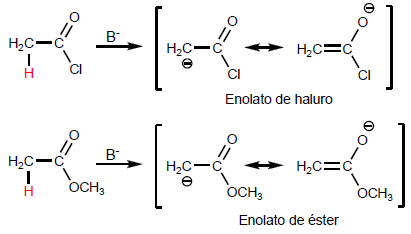
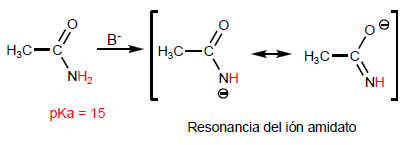
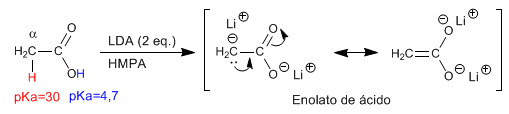
Os a -hidrogênios dos ácidos carboxílicos são ácidos e podem ser removidos usando bases fortes como LDA.
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 44733
A reação de Hell-Volhard-Zelinsky torna possível halogenar a posição a de ácidos carboxílicos. O bromo catalisado por fósforo é usado como reagente. O fósforo na presença de bromo gera tribrometo de fósforo, que na verdade é o composto que atua como catalisador.
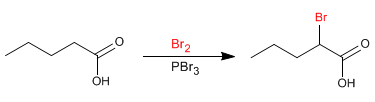
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 29439
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 33948
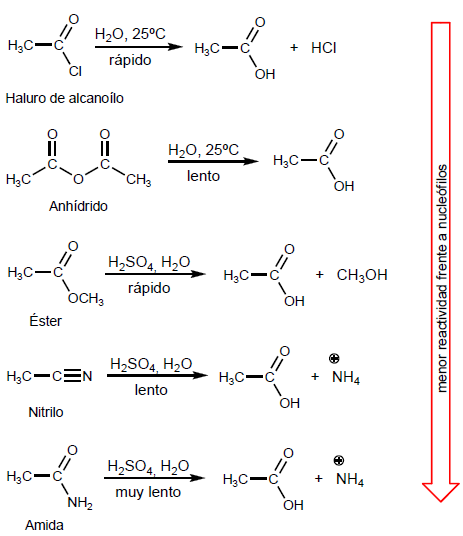
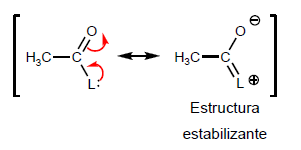
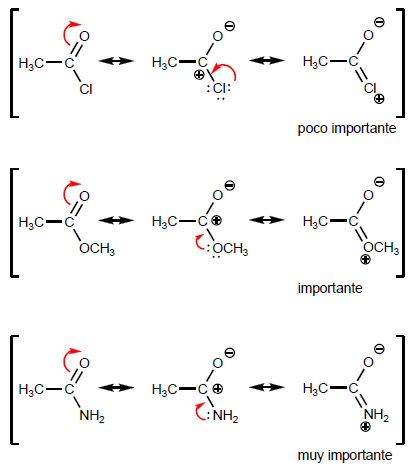
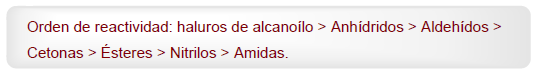
- Detalhes
- Germán Fernández
- TEORIA DOS ÁCIDOS CARBOXÍLICOS
- Acessos: 21976