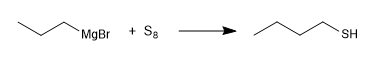Os tióis são caracterizados por conterem o grupo funcional -SH. Eles são nomeados terminando o nome da cadeia principal em -thiol, análogo aos álcoois cuja terminação é -ol
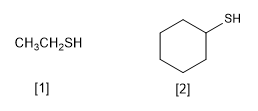
[1] Etanotiol
[2] Ciclohexanotiol
Os tióis têm uma acidez maior do que os álcoois devido ao tamanho maior do enxofre em comparação com o oxigênio. Os valores de pKa estão em torno de 10-11, em comparação com álcoois que possuem valores entre 16-18.
No entanto, o tamanho maior do enxofre favorece sua polarizabilidade e conseqüentemente sua nucleofilicidade. Os tióis são nucleófilos muito melhores do que os álcoois, sendo sua nucleofilicidade ainda mais aumentada pela desprotonação.
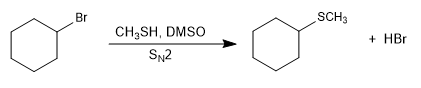
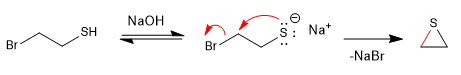
As reações do tipo S N 2 tornam-se mais rápidas na presença de um meio básico que gera o sal l-tiol (tiolato).
Mecanismo:
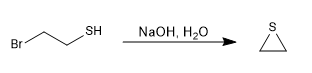
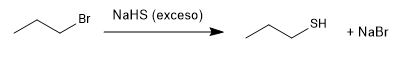
Os tióis são preparados a partir de sulfeto de hidrogênio de sódio e um haloalcano primário ou secundário.
O excesso de sulfeto de hidrogênio tenta minimizar a reação secundária pela qual o propanotiol reataca o brometo de propila para dar um tioéter.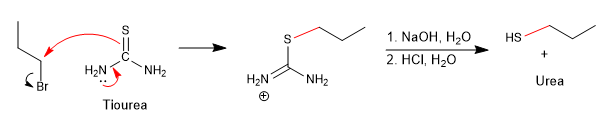
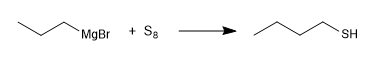
Uma maneira de evitar essa reação colateral é usar tioureia em combinação com um haloalcano.

Outro método de síntese consiste na reação do magnésio com o enxofre elementar.