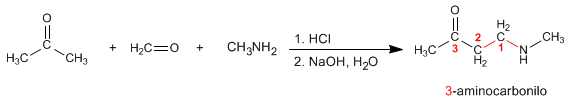TEORIA DAS AMINAS
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 142634
Regra 1. As aminas podem ser nomeadas como derivados de alquilaminas ou alcanoaminas. Vejamos alguns exemplos.
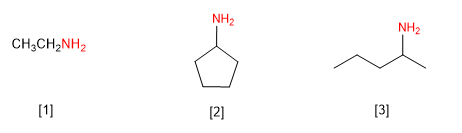
[1] Etilamina (Etanamina)
[2] Ciclopentilamina (Ciclopentanamina)
[3] (Pent-2-il)amina (Pentan-2-amina)
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 123947
As aminas têm pontos de fusão e ebulição mais baixos do que os álcoois. Assim, a etilamina ferve a 17ºC, enquanto o ponto de ebulição do etanol é 78ºC.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 76015
As aminas possuem hidrogênios ácidos no grupo amino. Esses hidrogênios podem ser subtraídos usando bases fortes (organometálicos, hidretos metálicos) formando amidas (bases amina).
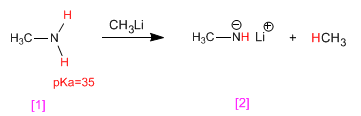
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 75561
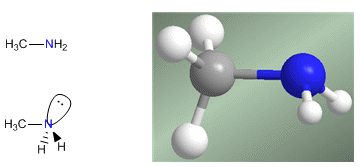
As aminas são compostos nitrogenados com estrutura piramidal, semelhante à amônia. O nitrogênio forma três ligações simples através de orbitais hibridizados sp 3 . O par solitário ocupa o quarto orbital com hibridação sp 3 e é responsável pelo comportamento básico e nucleofílico das aminas.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 58977
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 58249
Nitrilas podem ser preparadas pela reação de haloalcanos com cianeto de sódio. A redução de nitrilas com LiAlH 4 produz aminas.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 44723
A reação de haloalcanos primários e secundários com azida sódica produz alquilazidas, que por redução com LiAlH 4 dão origem a amidas.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 44628
Amidas são reduzidas com LiAlH 4 para formar aminas. O número de carbonos da amina final é igual ao da amida inicial.
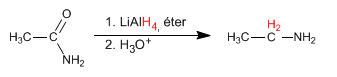
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 43389
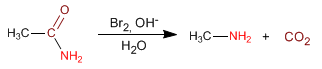
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 60995
A síntese de Gabriel permite obter aminas primárias a partir de haloalcanos, sem a formação de misturas de aminas secundárias e terciárias.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 58408
A aminação redutiva consiste em formar uma imina, a partir de aldeídos ou cetonas e aminas, que é reduzida a uma amina em uma etapa posterior. Esta redução pode ser realizada com $H_2$ catalisada por Níquel ou com $NaBH_3CN$.
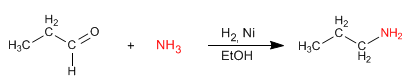
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 36192
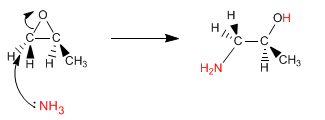
Os epóxidos (oxaciclopropanos) abrem por ataque nucleófilo, devido à significativa tensão do anel. Se o nucleófilo utilizado for amônia, obtém-se um β-aminoálcool. Este tipo de produto também pode ser obtido abrindo o epóxido com azida sódica e reduzindo a azida em uma segunda etapa.
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 67544
A eliminação de Hofmann permite a conversão de aminas em alcenos. É uma reação regiosseletiva que segue a regra de Hofmann, formando o alceno menos substituído.
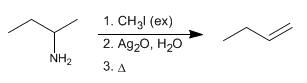
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 44362
A eliminação de Cope permite obter alcenos a partir de aminas terciárias. A reação consiste na oxidação da amina terciária, formando um N-óxido de amina, que é eliminado intramolecularmente por aquecimento, dando origem ao alceno.
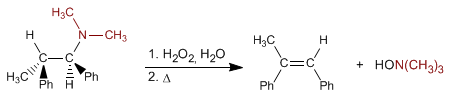
- Detalhes
- Germán Fernández
- TEORIA DAS AMINAS
- Acessos: 49044
Mannich prepara 3-aminocarbonilas a partir de aminas primárias ou secundárias, metano e uma carbonila enolizável. Vejamos um exemplo: