TEORIA DOS CICLOALCANOS
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 1995
Nomenclatura dos cicloalcanos 
Os cicloalcanos são nomeados com o prefixo ciclo- seguido do nome do alcano com o mesmo número de carbonos. Os cicloalcanos exibem isomeria cis/trans. Quando os substituintes estão na mesma face da molécula, dizemos que são cis; quando se encontram em lados opostos, dizem que são trans.
Propriedades físicas
Eles têm pontos de fusão e ebulição mais altos do que os alcanos correspondentes com o mesmo número de carbonos. A rigidez do anel permite um maior número de interações intermoleculares, que é necessário romper com a entrada de energia, para passar as moléculas para a fase gasosa.
tensão anular
Cicloalcanos de tamanho pequeno (ciclopropano, ciclobutano) apresentam estresse significativo devido aos ângulos de ligação e eclipsamento. Cicloalcanos maiores, como ciclopentano e ciclohexano, são quase livres de estresse.
Isômeros conformacionais em ciclohexano
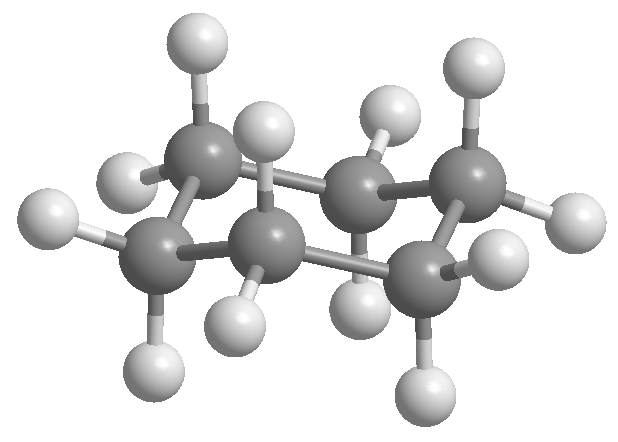
O ciclohexano é organizado na forma de uma cadeira para evitar o eclipsamento entre os hidrogênios. A forma de cadeira do ciclohexano contém dois tipos de hidrogênios; os axiais que estão localizados perpendicularmente ao plano da molécula e os equatoriais colocados no mesmo plano.
Equilíbrio equatorial-axial em ciclohexanos substituídos
O ciclohexano apresenta um equilíbrio conformacional que interconverte hidrogênios equatoriais em axiais e vice-versa. Quando se substitui um ciclohexano, a conformação que coloca mais grupos na posição equatorial é a mais estável, encontrando-se o equilíbrio conformacional deslocado para essa conformação.
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 164113
Os cicloalcanos são alcanos que possuem as extremidades da cadeia unidas, formando um ciclo. Eles têm dois hidrogênios a menos que o alcano do qual são derivados, razão pela qual sua fórmula molecular é CnH2n . Eles são nomeados usando o prefixo ciclo seguido pelo nome do alcano.
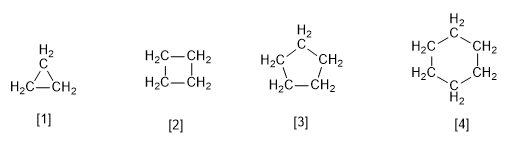
[1] Ciclopropano
[2] Ciclobutano
[3] Ciclopentano
[4] Ciclohexano
É comum representar moléculas indicando apenas seu esqueleto. Cada vértice representa um carbono ligado a dois hidrogênios. 
As regras da IUPAC para nomear cicloalcanos são muito semelhantes àquelas estudadas para alcanos.
Regra 1.- Nos cicloalcanos com um único substituinte, o ciclo é tomado como a cadeia principal da molécula. A numeração dos ciclos é desnecessária.
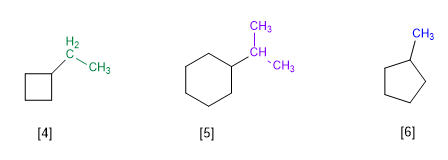
[4] Etilciclobutano
[5] Isopropilciclohexano
[6] Metilciclopentano
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 82458
Na natureza, os compostos com ciclos de cinco e seis elos são muito abundantes. No entanto, os ciclos de três e quatro membros aparecem muito raramente em produtos naturais.
Estabilidade em cicloalcanos
Esses fatos experimentais sugerem a maior estabilidade dos ciclos de cinco ou seis membros em relação aos de três ou quatro.
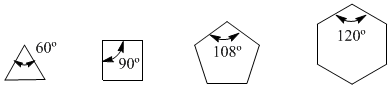
No ano de 1885, o químico alemão Adolf von Baeyer propôs que a instabilidade de pequenos ciclos se devia à tensão dos ângulos de ligação. Os carbonos sp 3 possuem ângulos de ligação natural de 109,5º, no ciclopropano esses ângulos são de 60º, o que é um desvio de 49,5º. Essa deflexão se traduz em estresse, que causa instabilidade na molécula.
O ciclobutano é mais estável, pois seus ângulos de ligação são de 90º e a deflexão é de apenas 19,5º. Baeyer aplicou esse raciocínio aos outros cicloalcanos e previu que o ciclopentano deveria ser mais estável que o ciclohexano.
tensão angular
Observe os ângulos de ligação dos diferentes cicloalcanos:
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 71255
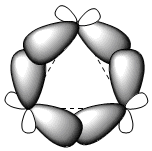 Os três átomos de carbono do ciclopropano estão no mesmo plano, ao contrário dos outros cicloalcanos que não são planares. O ciclopropano é caracterizado por uma grande tensão angular devido aos ângulos de ligação bem abaixo de 109,5°. O enorme estresse ao qual o ciclo é submetido faz com que as ligações carbono-carbono se dobrem para fora, dando origem a ligações muito características chamadas ligações "banana".
Os três átomos de carbono do ciclopropano estão no mesmo plano, ao contrário dos outros cicloalcanos que não são planares. O ciclopropano é caracterizado por uma grande tensão angular devido aos ângulos de ligação bem abaixo de 109,5°. O enorme estresse ao qual o ciclo é submetido faz com que as ligações carbono-carbono se dobrem para fora, dando origem a ligações muito características chamadas ligações "banana".
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 65678
O ciclobutano não é plano, um de seus carbonos sai cerca de 25º do plano formado pelos outros três carbonos. Esse arranjo aumenta a tensão angular, mas o eclipsamento hidrogênio-hidrogênio que a molécula apresenta em sua forma planar é consideravelmente reduzido.
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 51983
Se o ciclopentano fosse planar, seria praticamente livre de tensão angular. Mas apresentaria cinco hidrogênios eclipsados para cada face, o que desestabilizaria a molécula. O arranjo mais favorável do ciclopentano é a forma de envelope. Nesse arranjo, a soma das tensões angulares e do eclipsamento é mínima.
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 73864
 Ciclos de seis são os mais abundantes na natureza. Existem muitos compostos com atividade biológica cuja base são ciclos de seis átomos condensados (colesterol).
Ciclos de seis são os mais abundantes na natureza. Existem muitos compostos com atividade biológica cuja base são ciclos de seis átomos condensados (colesterol).
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 76196
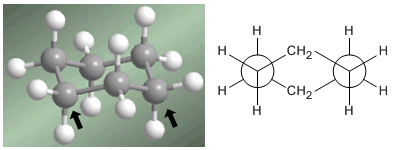
O professor Odd Hassel, da Universidade de Oslo, estabeleceu que a conformação mais estável do ciclohexano é a forma de cadeira. Com ângulos de ligação de 111º a cadeira está quase livre de tensões angulares. Além disso, todos os links são escalonados, como pode ser visto na projeção de Newman.
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 3285
O ciclohexano apresenta um equilíbrio conformacional em que os hidrogênios axiais, em vermelho, se movem para a posição equatorial. Os hidrogênios equatoriais, em verde, giram para a posição axial.
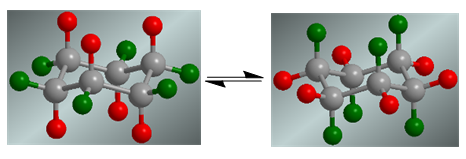
Na ausência de substituintes, ambas as conformações têm a mesma probabilidade de existir e o equilíbrio coformacional não é deslocado.
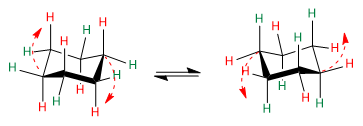
Observe as setas vermelhas para entender como ocorre a transição de uma conformação para outra.
- Detalhes
- Germán Fernández
- TEORIA DOS CICLOALCANOS
- Acessos: 4931
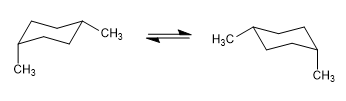
No modelo a seguir pode-se ver que no confôrmero equatorial o grupo metil está distante do resto dos grupos. Pelo contrário, no conformador axial, o referido grupo metil está voltado para os hidrogênios axiais que estão localizados na posição 3 em relação a ele. Essa proximidade espacial causa uma repulsão estérica, chamada de interação 1,3-diaxial.
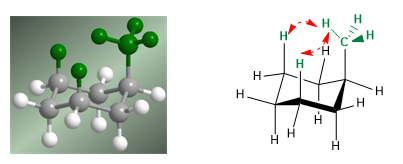
A interação diaxial 1,3 causa um deslocamento do equilíbrio conformacional para a esquerda. A conformação à direita tem alta energia devido à repulsão entre os hidrogênios metílico e axial.
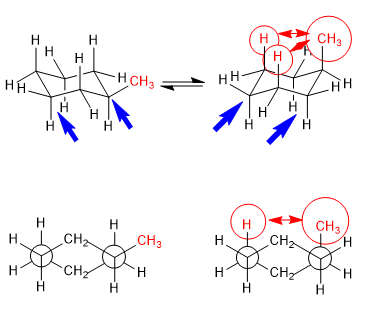
Equilíbrio em trans-1,4-dimetilciclohexano
As interações 1,3-diaxiais fazem com que os substituintes tendam a se localizar em posições equatoriais. Assim, no trans-1,4-dimetilciclohexano a conformação com os dois grupos metil em equatorial é mais estável que a cadeira com metils axiais, isso produz um deslocamento do equilíbrio conformacional para a esquerda.
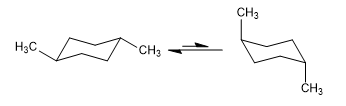
Equilíbrio em cis-1,4-dimetilciclohexano