Os álcoois são espécies anfotéricas (anfipróticas), podem atuar como ácidos ou bases. Em solução aquosa estabelece-se um equilíbrio entre álcool, água e suas bases conjugadas.
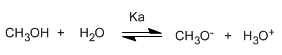
Escrevendo a constante de equilíbrio (Ka)
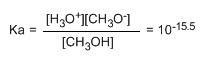
O pequeno valor da constante nos diz que o equilíbrio está totalmente deslocado para a esquerda. A alteração do logaritmo da constante de equilíbrio nos dá o pKa do metanol, parâmetro que indica o grau de acidez de um composto orgânico.
pKa = - log ka = 15,5
Um aumento no pKa implica uma diminuição na acidez. Assim, o metanol com um pka de 15,5 é ligeiramente mais ácido do que o etanol com um pka de 15,9.
O pKa dos álcoois é influenciado por alguns fatores como o tamanho da cadeia carbônica e os grupos eletronegativos.
À medida que o comprimento da cadeia de carbono aumenta, o álcool torna-se menos ácido.
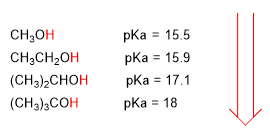
menor acidez
Grupos eletronegativos (halogênios) aumentam a acidez dos álcoois (diminuem o pKa)
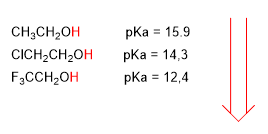
maior acidez