Os diferentes arranjos espaciais que uma molécula pode adotar e que são interconvertidos à temperatura ambiente por rotação são chamados de conformações.
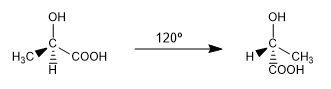
São duas das infinitas conformações que podem ser extraídas do ac. 2-hidroxipropanóico. À temperatura ambiente, a molécula está continuamente girando em todas as conformações possíveis.
Agora vamos ver as duas conformações mais características do etano, as conformações alternada e eclipsada.
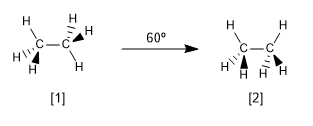
[1] Conformação alternativa do etano
[2] Conformação eclipsada do etano
Algumas reações são altamente dependentes da conformação em que a molécula está disposta. Assim, a eliminação de E2 requer que as moléculas adotem o arranjo ANTI e sua velocidade é dependente da concentração de moléculas que estão nesta conformação.
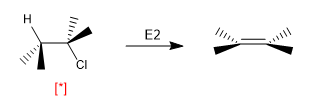
[*] Arranjo H-Cl "ANTI"
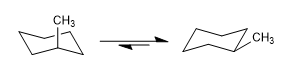
Os ciclohexanos também têm duas conformações de cadeira que se interconvertem à temperatura ambiente. A conformação que deixa mais grupos na posição equatorial costuma ser a de maior estabilidade.
Outro exemplo de equilíbrio conformacional é apresentado pelos bifenilos. Quando os dois anéis estão dispostos no mesmo plano formam um sistema aromático, girar 90º quebra a conjugação entre eles e torna a molécula mais instável.
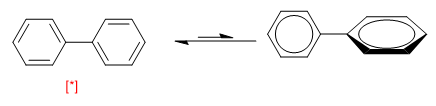
[*] Conformação mais estável
No entanto, a presença de grupos volumosos nas posições orto em relação a ambos os anéis produz repulsões que forçam a rotação da molécula, neste caso a conformação com os anéis perpendiculares é mais estável.
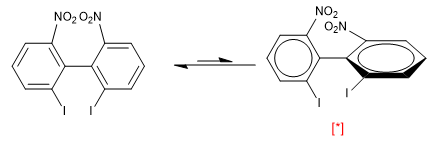
[*] Conformação mais estável
À temperatura ambiente, apenas a conformação mais estável é observada (lado direito). A repulsão entre os dois nitros e os dois iodos é tão importante que a rotação do bifenilo tem uma energia de ativação de 19 Kca/mol.
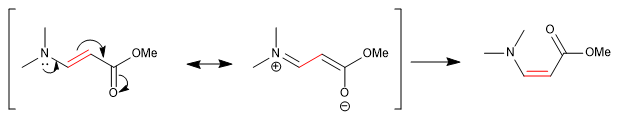
Alguns links, embora aparentemente simples, não permitem que os grupos girem livremente em torno deles. Os metil DMF fornecem dois singletos, em diferentes deslocamentos químicos, no espectro de NMR porque a ligação CN tem forte caráter de ligação dupla e restringe a rotação do grupo.
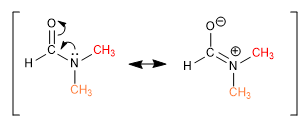
Outras ligações, aparentemente duplas, permitem a rotação devido à contribuição de uma estrutura ressonante na qual se comportam como ligações simples.