ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 134569
Карбоновые кислоты получают название путем добавления окончания -овая к названию алкана с тем же числом атомов углерода. Кроме того, название завершается словом кислота.
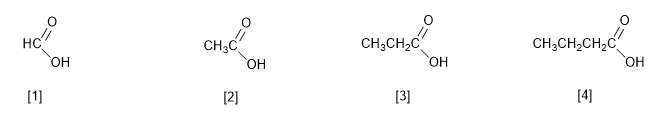
[1] Метановая кислота (муравьиная кислота)
[2] Этановая кислота (уксусная кислота)
[3] Пропановая кислота (пропионовая кислота)
[4] Бутановая кислота (масляная кислота)
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 115742
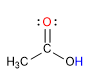
Карбоновые кислоты представляют собой молекулы с плоской тригональной геометрией. Они имеют кислый водород в гидроксильной группе и ведут себя как основания по карбонильному кислороду.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 86932
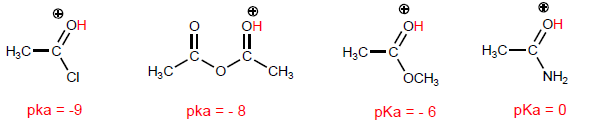
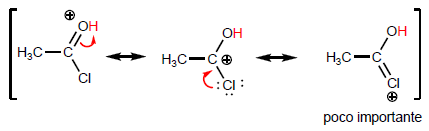
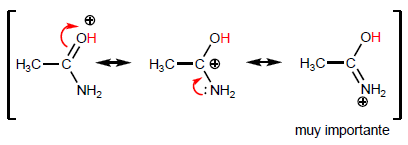
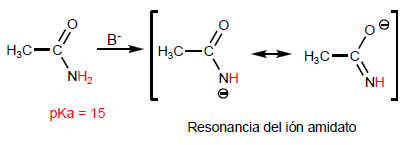
Наиболее характерным свойством карбоновых кислот является кислотность водорода, расположенного на гидроксильной группе. pKa этого водорода колеблется от 4 до 5 в зависимости от длины углеродной цепи.
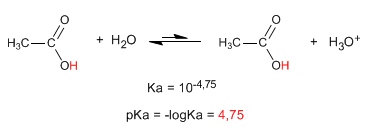
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 141511
Карбоновые кислоты можно получить следующими способами:
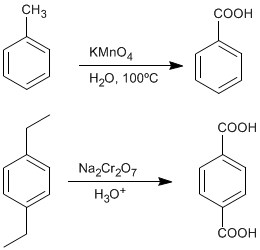
♦ Окисление алкилбензолов: карбоновые кислоты могут быть получены из бензолов, замещенных алкильными группами, путем окисления перманганатом калия или дихроматом натрия.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 62450
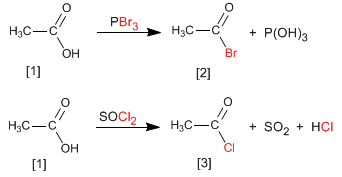
Алканоилгалогениды получают реакцией карбоновых кислот с PBr 3 . Также можно использовать SOCl 2 .
Таким образом, этановая кислота превращается в этанолилбромид реакцией с трибромидом фосфора. Этановая кислота реагирует с тионилхлоридом с образованием соединения
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 72995
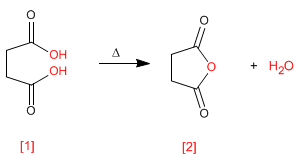
Ангидриды получают конденсацией карбоновых кислот с потерей воды. Реакция требует сильного нагрева и длительного времени реакции.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 111624
Сложные эфиры получают реакцией карбоновых кислот и спиртов в присутствии минеральных кислот. Реакцию проводят в избытке спирта, чтобы сместить равновесие вправо. Присутствие воды вредно, так как она гидролизует образовавшийся эфир.
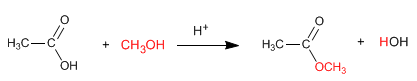
Подробнее: Синтез сложных эфиров карбоновых кислот - Этерификация
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 69934
Лактоны представляют собой циклические сложные эфиры, которые получают путем внутримолекулярной этерификации из молекул, содержащих кислотные и спиртовые группы. Эта циклизация образует 5- или 6-членные циклы.
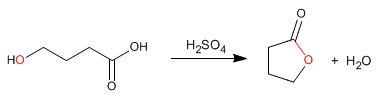
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 78509
Амиды образуются при взаимодействии карбоновых кислот с аммиаком, первичными и вторичными аминами. Реакцию проводят при нагревании.
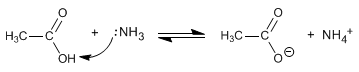
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 46747
Лактамы представляют собой циклические амиды, образованные из молекул, содержащих карбоксильные и аминогруппы. Реакцию проводят при нагревании в отсутствие кислоты.
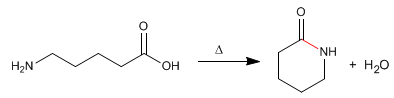
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 44953
Карбоновые кислоты реагируют с двумя эквивалентами органолита с последующим водным гидролизом с образованием кетонов.
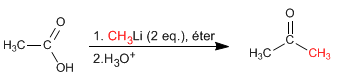
Подробнее: Взаимодействие карбоновых кислот с металлоорганическими соединениями
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 68836
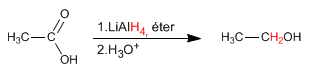
Алюмогидрид лития восстанавливает карбоновые кислоты до спиртов.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 32502
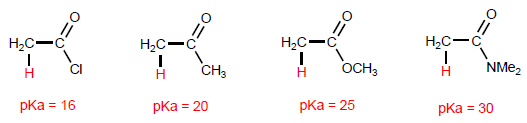
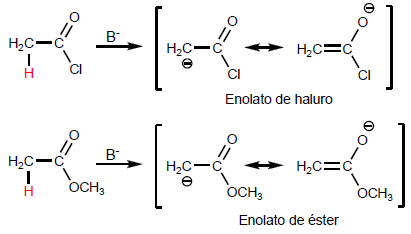
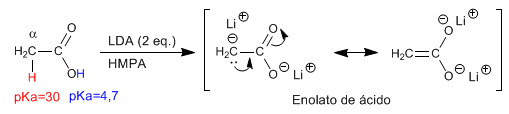
α -водороды карбоновых кислот являются кислыми и могут быть удалены с помощью сильных оснований, таких как LDA.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 44631
Реакция Хелла-Фольхарда-Зелинского позволяет галогенировать а-положение карбоновых кислот. В качестве реагента используется катализируемый фосфором бром. Фосфор в присутствии брома образует трибромид фосфора, который на самом деле является соединением, действующим как катализатор.
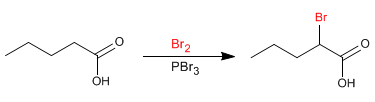
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 29415
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 33746
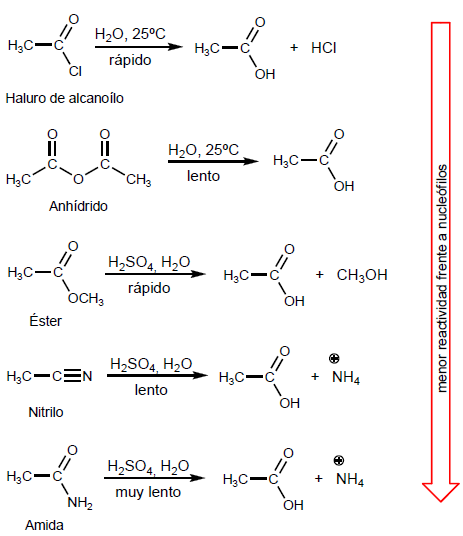
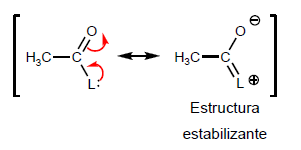
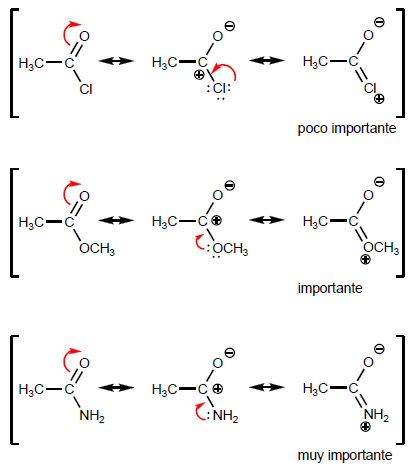
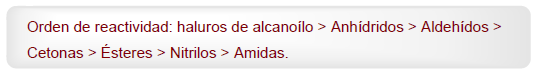
- Информация о материале
- Germán Fernández
- ТЕОРИЯ КАРБОНОВЫХ КИСЛОТ
- Просмотров: 21493