THEORIE DER CARBONSÄUREN
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 135534
Die IUPAC benennt Carbonsäuren, indem sie den Namen des Alkans mit der gleichen Anzahl von Kohlenstoffatomen mit -säure abschließt.
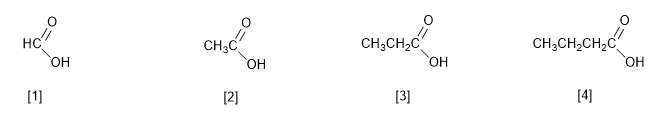
[1] Methansäure (Ameisensäure)
[2 ] Ethansäure (Essigsäure)
[3 ] Propansäure (Propionsäure)
[4 ] Butansäure (Buttersäure)
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 115833
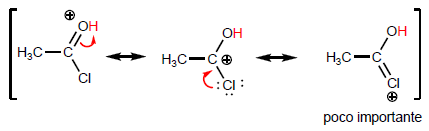
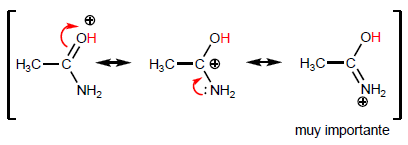
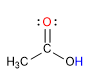
Carbonsäuren sind Moleküle mit trigonaler planarer Geometrie. Sie haben sauren Wasserstoff in der Hydroxylgruppe und verhalten sich am Carbonylsauerstoff wie Basen.
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 87447
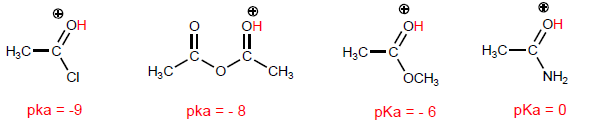
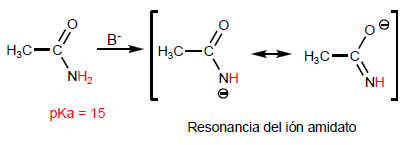
Die charakteristischste Eigenschaft von Carbonsäuren ist die Acidität des Wasserstoffs, der sich an der Hydroxylgruppe befindet. Der pKa dieses Wasserstoffs reicht von 4 bis 5, abhängig von der Länge der Kohlenstoffkette.
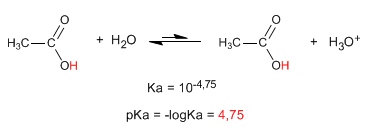
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 143453
Carbonsäuren können nach folgenden Methoden hergestellt werden:
♦ Oxidation von Alkylbenzolen: Carbonsäuren können aus alkylsubstituierten Benzolen durch Oxidation mit Kaliumpermanganat oder Natriumdichromat gewonnen werden.
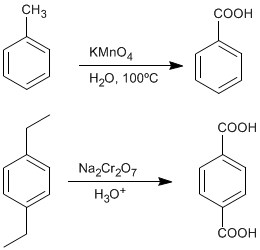
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 65101
Alkanoylhalogenide werden durch Umsetzung von Carbonsäuren mit PBr 3 erhalten. Es kann auch SOCl 2 verwendet werden.
So wird Ethansäure durch Reaktion mit Phosphortribromid in Ethanoylbromid umgewandelt. Essigsäure reagiert mit Thionylchlorid unter Bildung der Verbindung
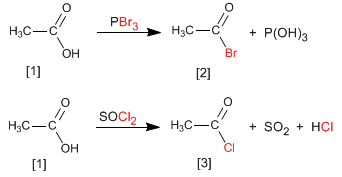
Weiterlesen: Synthese von Alkanoylhalogeniden aus Carbonsäuren
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 73157
Die Anhydride werden durch Kondensation von Carbonsäuren unter Wasserverlust erhalten. Die Reaktion erfordert starkes Erhitzen und eine lange Reaktionszeit.
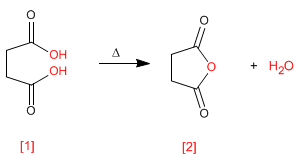
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 111329
Ester werden durch Umsetzung von Carbonsäuren und Alkoholen in Gegenwart von Mineralsäuren erhalten. Die Reaktion wird im Überschuss an Alkohol durchgeführt, um die Gleichgewichte nach rechts zu verschieben. Die Anwesenheit von Wasser ist nachteilig, da es den gebildeten Ester hydrolysiert.
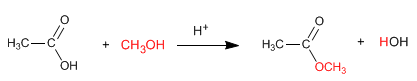
Weiterlesen: Synthese von Estern aus Carbonsäuren - Veresterung
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 69803
Lactone sind cyclische Ester, die durch intramolekulare Veresterung aus säure- und alkoholgruppenhaltigen Molekülen gewonnen werden. Diese Cyclisierung bildet 5- oder 6-gliedrige Zyklen.
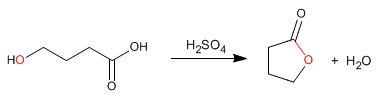
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 79212
Amide entstehen durch die Reaktion von Carbonsäuren mit Ammoniak, primären und sekundären Aminen. Die Reaktion wird unter Erhitzen durchgeführt.
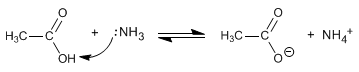
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 46639
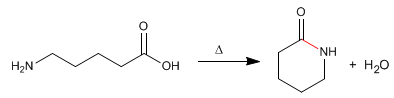
Lactame sind cyclische Amide, die aus Molekülen gebildet werden, die Carboxyl- und Amingruppen enthalten. Die Reaktion wird durch Erhitzen in Abwesenheit von Säure durchgeführt.
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 45571
Carbonsäuren reagieren mit zwei Äquivalenten Organolyse, gefolgt von wässriger Hydrolyse, um Ketone zu bilden.
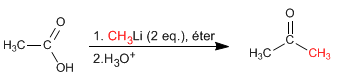
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 70298
Lithiumaluminiumhydrid reduziert Carbonsäuren zu Alkoholen.
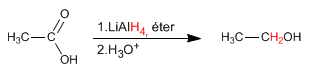
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 33083
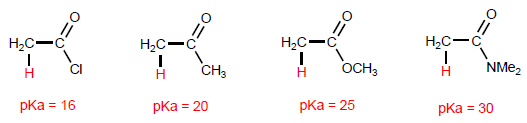
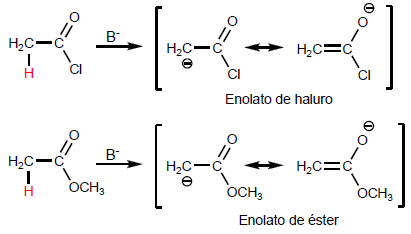
Die a -Wasserstoffe von Carbonsäuren sind sauer und können unter Verwendung starker Basen wie LDA entfernt werden.
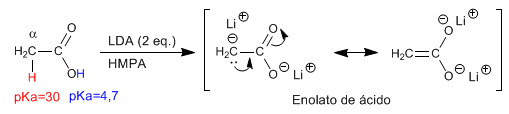
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 44594
Die Hell-Volhard-Zelinsky-Reaktion ermöglicht die Halogenierung der a-Position von Carbonsäuren. Als Reagenz wird phosphorkatalysiertes Brom verwendet. Phosphor in Gegenwart von Brom erzeugt Phosphortribromid, das eigentlich die Verbindung ist, die als Katalysator wirkt.
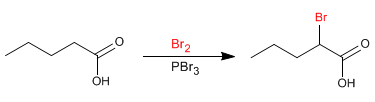
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 29437
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 34691
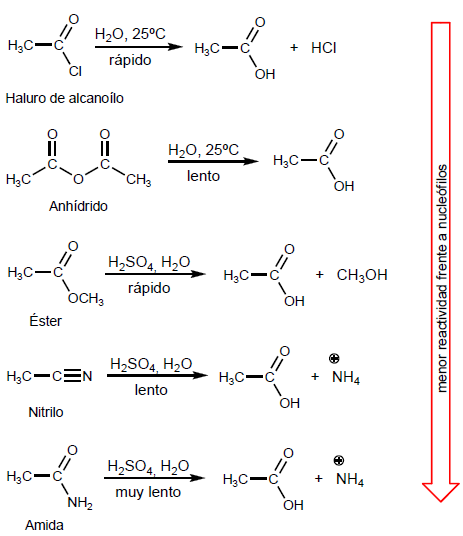
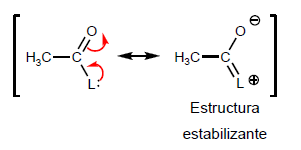
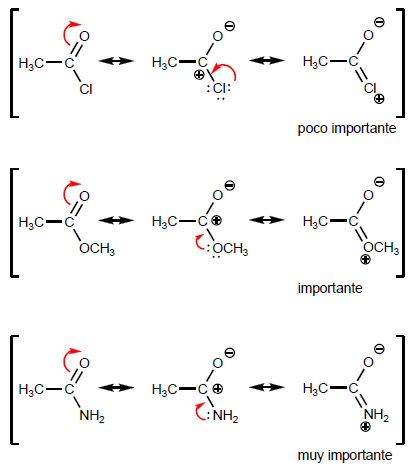
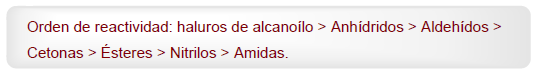
- Details
- Germán Fernández
- THEORIE DER CARBONSÄUREN
- Zugriffe: 21877