TEORI ASAM KARBOKSILAT
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 135813
IUPAC menamai asam karboksilat dengan mengganti akhiran -o pada alkana dengan jumlah karbon yang sama dengan -oat . Selain itu, nama kata asam didahului.
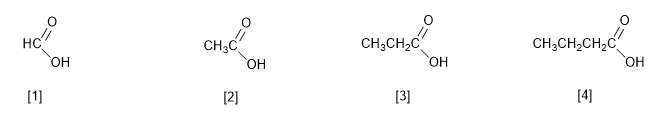
[1] Asam metanoat (asam format)
[2 ] Asam etanoat (Asam asetat)
[3 ] Asam propanoat (Asam propionat)
[4 ] Asam butanoat (asam butirat)
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 117679
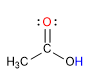
Asam karboksilat adalah molekul dengan geometri trigonal planar. Mereka memiliki hidrogen asam dalam gugus hidroksil dan berperilaku seperti basa pada oksigen karbonil.
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 88225
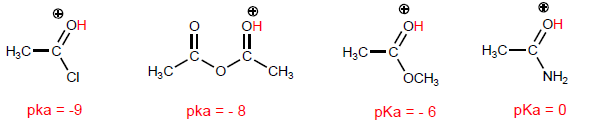
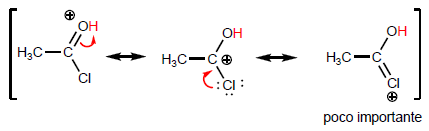
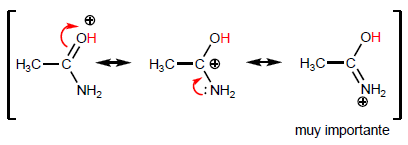
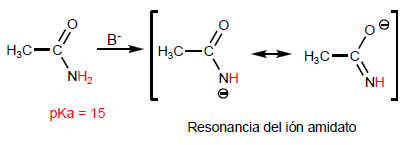
Sifat paling khas dari asam karboksilat adalah keasaman hidrogen yang terletak pada gugus hidroksil. pKa hidrogen ini berkisar dari 4 sampai 5 tergantung pada panjang rantai karbon.
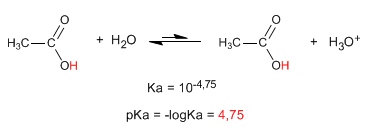
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 146848
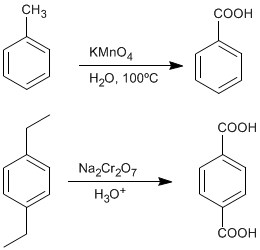
Asam karboksilat dapat dibuat dengan menggunakan metode berikut:
♦ Oksidasi alkilbenzena: Asam karboksilat dapat diperoleh dari benzena yang disubstitusi dengan gugus alkil melalui oksidasi dengan kalium permanganat atau natrium dikromat.
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 63993
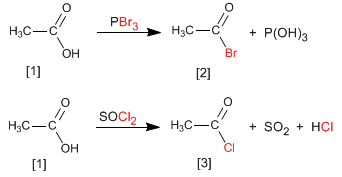
Alkanoil halida diperoleh dengan mereaksikan asam karboksilat dengan PBr 3 . SOCl 2 juga dapat digunakan.
Jadi, asam etanoat diubah menjadi etanoil bromida melalui reaksi dengan fosfor tribromida. Asam etanoat bereaksi dengan tionil klorida untuk membentuk senyawa
Selengkapnya: Sintesis alkanoil halida dari asam karboksilat
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 73548
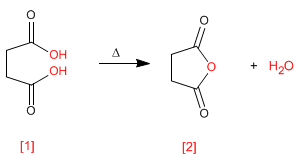
Anhidrida diperoleh dengan kondensasi asam karboksilat dengan kehilangan air. Reaksi membutuhkan pemanasan yang kuat dan waktu reaksi yang lama.
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 112724
Ester diperoleh dengan reaksi asam karboksilat dan alkohol dengan adanya asam mineral. Reaksi dilakukan dalam alkohol berlebih untuk menggeser kesetimbangan ke kanan. Kehadiran air merugikan karena menghidrolisis ester yang terbentuk.
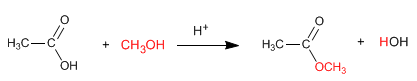
Selengkapnya: Sintesis ester dari asam karboksilat - Esterifikasi
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 70780
Lakton adalah ester siklik yang diperoleh dengan esterifikasi intramolekul dari molekul yang mengandung gugus asam dan alkohol. Siklisasi ini membentuk siklus beranggotakan 5 atau 6.
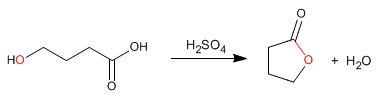
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 80242
Amida dibentuk oleh reaksi asam karboksilat dengan amonia, amina primer dan sekunder. Reaksi dilakukan di bawah pemanasan.
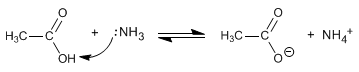
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 47568
Laktam adalah amida siklik yang terbentuk dari molekul yang mengandung gugus karboksilat dan amina. Reaksi dilakukan dengan pemanasan tanpa adanya asam.
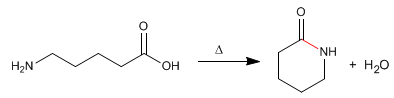
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 45423
Asam karboksilat bereaksi dengan dua ekuivalen organolitik diikuti dengan hidrolisis berair untuk membentuk keton.
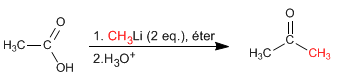
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 66571
Litium aluminium hidrida mereduksi asam karboksilat menjadi alkohol.
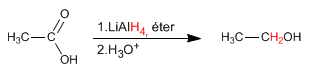
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 32565
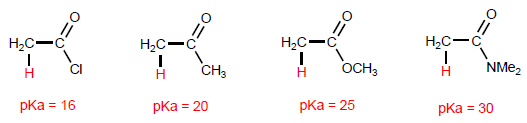
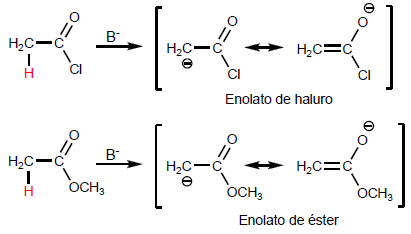
Hidrogen- a dari asam karboksilat bersifat asam dan dapat dihilangkan menggunakan basa kuat seperti LDA.
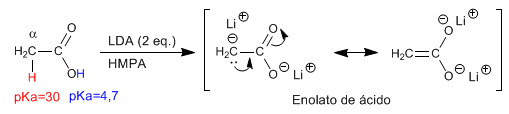
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 44824
Reaksi Hell-Volhard-Zelinsky memungkinkan untuk menghalogenasi posisi-a asam karboksilat. Brom yang dikatalisis fosfor digunakan sebagai reagen. Fosfor dengan adanya brom menghasilkan fosfor tribromida, yang sebenarnya merupakan senyawa yang bertindak sebagai katalis.
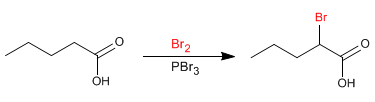
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 29686
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 34587
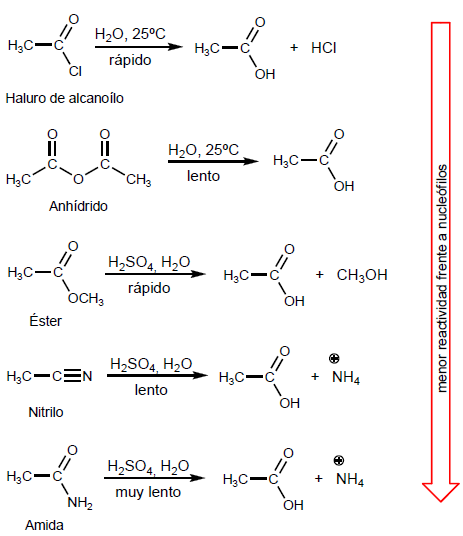
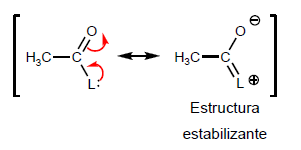
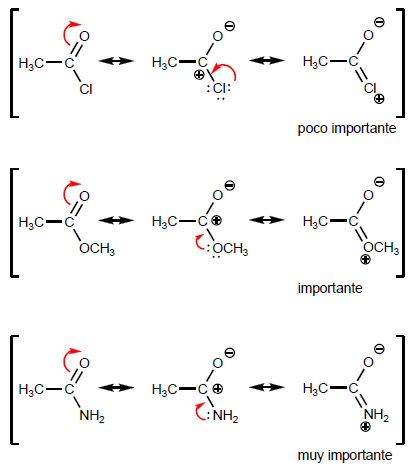
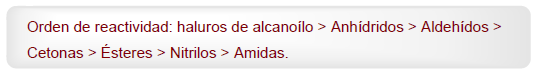
- Detail
- Germán Fernández
- TEORI ASAM KARBOKSILAT
- Dilihat: 21806