THÉORIE DES ACIDES CARBOXYLIQUES
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 136318
L'IUPAC nomme les acides carboxyliques en remplaçant la terminaison -e de l'alcane par le même nombre de carbones par -oïque. En outre, le nom de l'acide est précédé du mot acide
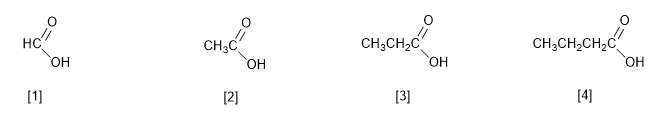
[1] Acide méthanoïque (acide formique)
[2 ] Acide éthanoïque (acide acétique)
[3 ] Acide propanoïque (Acide propionique)
[4 ] Acide butanoïque (Acide butyrique)
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 115759
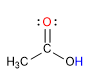
Les acides carboxyliques sont des molécules à géométrie plane trigonale. Ils ont de l'hydrogène acide dans le groupe hydroxyle et se comportent comme des bases sur l'oxygène carbonyle.
Lire la suite : Propriétés physiques des acides carboxyliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 88410
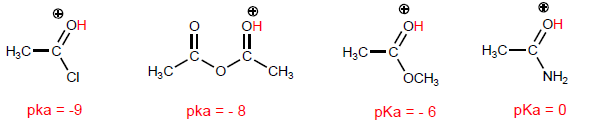
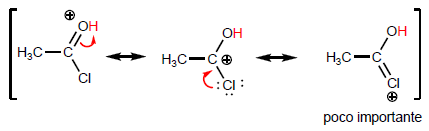
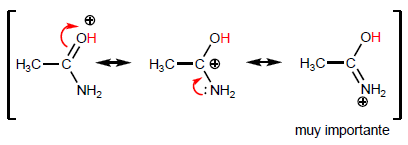
La propriété la plus caractéristique des acides carboxyliques est l'acidité de l'hydrogène situé sur le groupe hydroxyle. Le pKa de cet hydrogène varie de 4 à 5 selon la longueur de la chaîne carbonée.
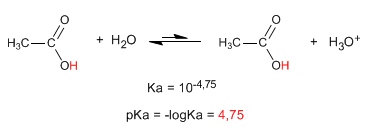
Lire la suite : Acidité et basicité des acides carboxyliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 144055
Les acides carboxyliques peuvent être préparés en utilisant les méthodes suivantes :
♦ Oxydation des alkylbenzènes : Les acides carboxyliques peuvent être obtenus à partir de benzènes substitués par des groupements alkyles par oxydation au permanganate de potassium ou au dichromate de sodium.
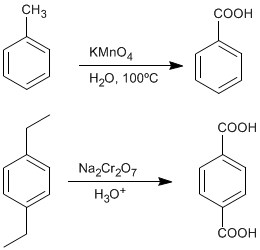
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 63556
Les halogénures d'alcanoyle sont obtenus en faisant réagir des acides carboxyliques avec du PBr 3 . SOCl 2 peut également être utilisé.
Ainsi, l'acide éthanoïque est transformé en bromure d'éthanoyle par réaction avec le tribromure de phosphore. L'acide éthanoïque réagit avec le chlorure de thionyle pour former le composé
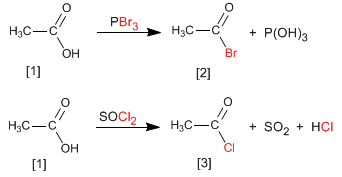
Lire la suite : Synthèse d'halogénures d'alcanoyle à partir d'acides carboxyliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 74266
Les anhydrides sont obtenus par condensation d'acides carboxyliques avec perte d'eau. La réaction nécessite un fort chauffage et un long temps de réaction.
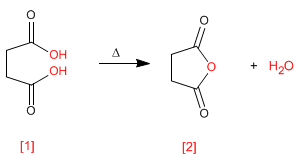
Lire la suite : Synthèse d'anhydrides à partir d'acides carboxyliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 113207
Les esters sont obtenus par réaction d'acides carboxyliques et d'alcools en présence d'acides minéraux. La réaction est conduite en excès d'alcool pour déplacer les équilibres vers la droite. La présence d'eau est préjudiciable car elle hydrolyse l'ester formé.
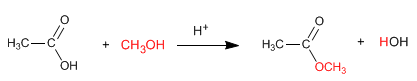
Lire la suite : Synthèse d'esters à partir d'acides carboxyliques - Estérification
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 72360
Les lactones sont des esters cycliques obtenus par estérification intramoléculaire à partir de molécules contenant des groupements acides et alcools. Cette cyclisation forme des cycles à 5 ou 6 chaînons.
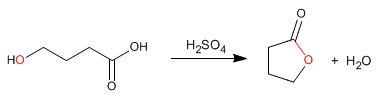
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 80833
Les amides sont formés par la réaction d'acides carboxyliques avec de l'ammoniac, des amines primaires et secondaires. La réaction est effectuée sous chauffage.
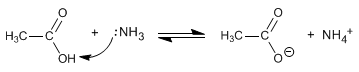
Lire la suite : Synthèse d'amides à partir d'acides carboxyliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 47446
Les lactames sont des amides cycliques formés à partir de molécules contenant des groupes carboxyliques et amines. La réaction est effectuée par chauffage en l'absence d'acide.
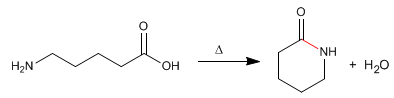
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 45384
Les acides carboxyliques réagissent avec deux équivalents d'organolytiques suivis d'une hydrolyse aqueuse pour former des cétones.
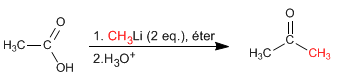
Lire la suite : Réaction des acides carboxyliques avec des organométalliques
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 69869
L'hydrure de lithium et d'aluminium réduit les acides carboxyliques en alcools.
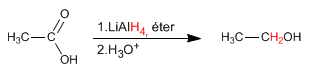
Lire la suite : Réduction des acides carboxyliques en alcools
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 33697
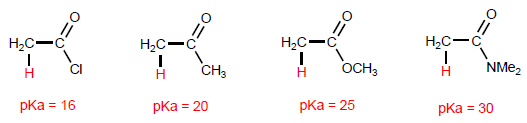
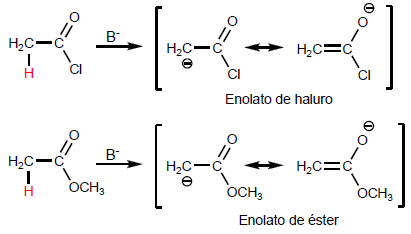
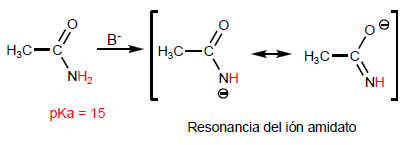
Les a -hydrogènes des acides carboxyliques sont acides et peuvent être éliminés à l'aide de bases fortes telles que le LDA.
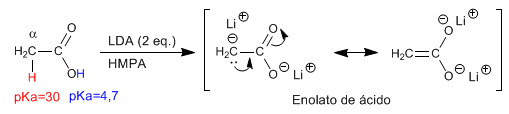
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 45329
La réaction Hell-Volhard-Zelinsky permet d'halogéner la position a des acides carboxyliques. Le brome catalysé au phosphore est utilisé comme réactif. Le phosphore en présence de brome génère du tribromure de phosphore, qui est en fait le composé qui agit comme catalyseur.
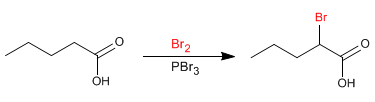
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 29698
La réaction de Hunsdiecker permet de préparer des bromoalcanes à partir d'acides carboxyliques. Dans cette réaction, l'acide est traité avec du nitrate d'argent en milieu basique, formant le carboxylate d'argent. Dans une étape ultérieure, la décarboxylation du carboxylate se produit par traitement avec du brome dissous dans du tétrachlorure de carbone.
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 34748
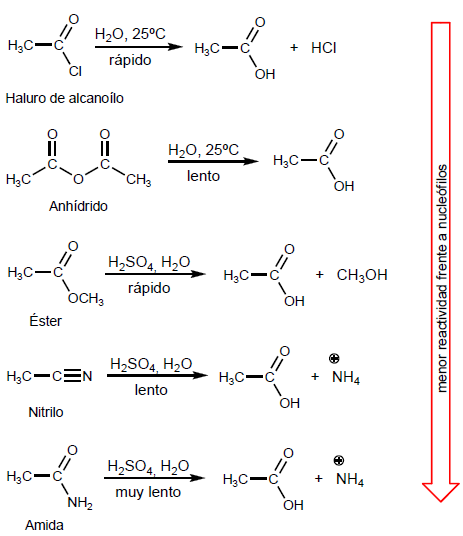
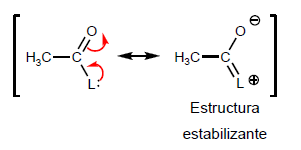
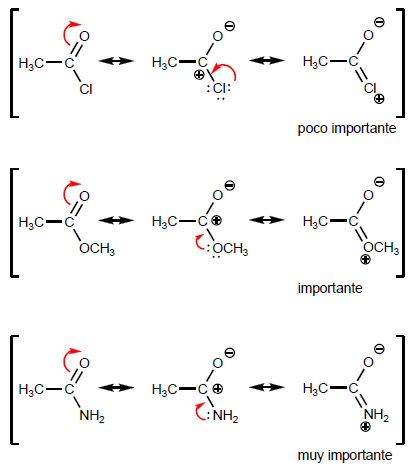
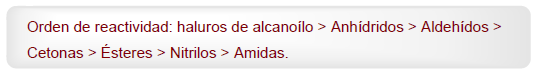
- Détails
- Germán Fernández
- THÉORIE DES ACIDES CARBOXYLIQUES
- Affichages : 21834