¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 224860
La IUPAC nombra los ácidos carboxílicos reemplazando la terminación -o del alcano con igual número de carbonos por -oico. Además, se precede el nombre de la palabra ácido.
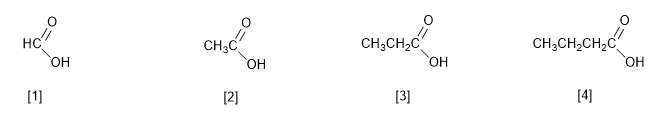
[1 ] Ácido metanoico (Ácido fórmico)
[2 ] Ácido etanoico (Ácido acético)
[3 ] Ácido propanoico (Ácido propiónico)
[4 ] Ácido butanoico (Ácido butírico)
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 188267
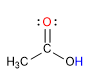
Los ácidos carboxílicos son moléculas con geometría trigonal plana. Presentan hidrógeno ácido en el grupo hidroxilo y se comportan como bases sobre el oxígeno carbonílico.
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 116369
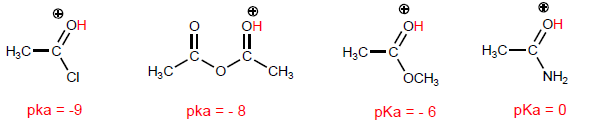
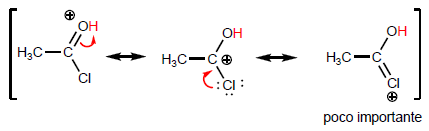
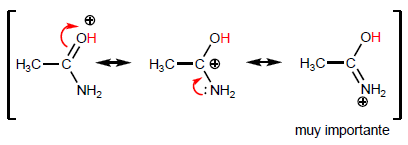
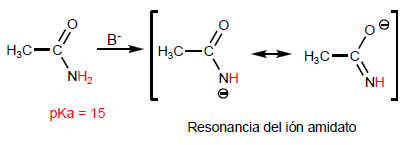
La propiedad más característica de los ácidos carboxílicos es la acidez del hidrógeno situado sobre el grupo hidroxilo. El pKa de este hidrógeno oscila entre 4 y 5 dependiendo de la longitud de la cadena carbonada.
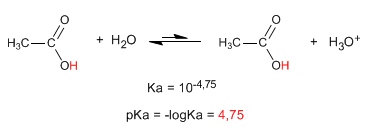
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 199416
Los ácidos carboxílicos pueden prepararse utilizando los siguientes métodos:
♦ Oxidación de alquilbencenos: Los ácidos carboxílicos pueden obtenerse a partir de bencenos sustituidos con grupos alquilo por oxidación con permanganato de potasio o dicromato de sodio.
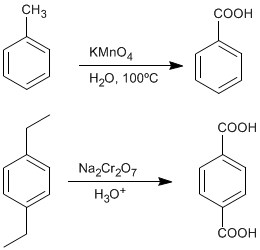
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 83863
Los haluros de alcanoilo se obtienen por reacción de ácidos carboxílicos con PBr3 . También se puede emplear SOCl2 .
Así, el ácido etanoico [1] se transforma en bromuro de etanoilo [2] por reacción con tribromuro de fósforo. El ácido etanoico por reacción con cloruro de tionilo forma el compuesto [3]
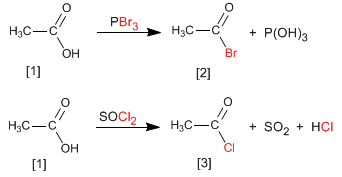
Leer más: Síntesis de haluros de alcanoilo a partir de ácidos carboxílicos
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 96975
Los anhidridos se obtienen por condensación de ácidos carboxílicos con pérdida de agua. La reacción requiere fuerte calefacción y tiempo de reacción largo.
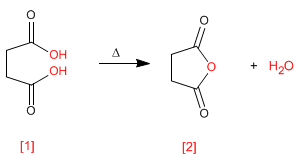
Leer más: Síntesis de Anhídridos a partir de Acidos Carboxílicos
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 154167
Los ésteres se obtienen por reacción de ácidos carboxílicos y alcoholes en presencia de ácidos minerales. La reacción se realiza en exceso de alcohol para desplazar los equilibrios a la derecha. La presencia de agua es perjudicial puesto que hidroliza el éster formado.
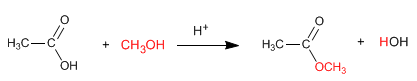
Leer más: Síntesis de ésteres a partir de ácidos carboxílicos - Esterificación
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 92712
Las lactonas son ésteres cíclicos que se obtienen mediante esterificación intramolecular a partir de moléculas que contienen grupos ácido y alcohol. Esta ciclación forma ciclos de 5 o 6 miembros.
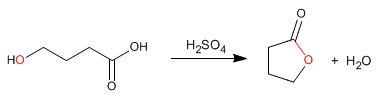
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 107538
Las amidas se forman por reacción de ácidos carboxílicos con amoniaco, aminas primarias y secundarias. La reacción se realiza bajo calefacción.
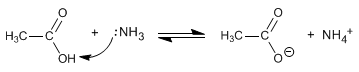
Leer más: Síntesis de amidas a partir de ácidos carboxílicos
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 59257
Las lactamas son amidas cíclicas formadas a partir de moléculas que contienen grupos carboxílico y amina. La reacción se realiza por calefacción en ausencia de ácido.
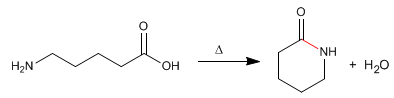
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 53618
Los ácidos carboxílicos reaccionan con dos equivalentes de organolíticos seguido de hidrólisis acuosa para formar cetonas.
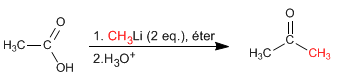
Leer más: Reacción de ácidos carboxílicos con organometálicos
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 85192
El hidruro de litio y aluminio reduce ácidos carboxílicos a alcoholes.
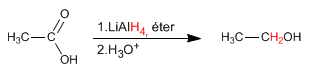
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 40153
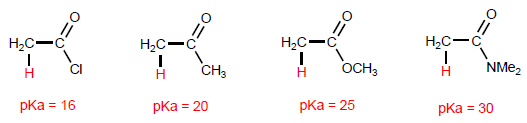
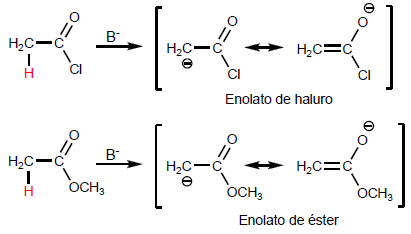
Los hidrógenos a de los ácidos carboxílicos son ácidos y se pueden arrancar empleando bases fuertes como LDA
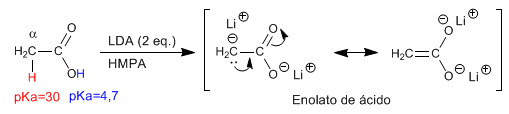
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 56203
La reacción de Hell - Volhard - Zelinsky permite halogenar la posición a de los ácidos carboxílicos. Como reactivo se emplea bromo catalizado por fósforo. El fósforo en presencia de bromo genera tribromuro de fósforo que es en realidad el compuesto que actúa de catalizador.
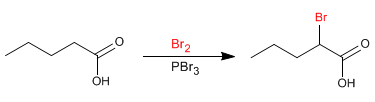
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 34898
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 50300
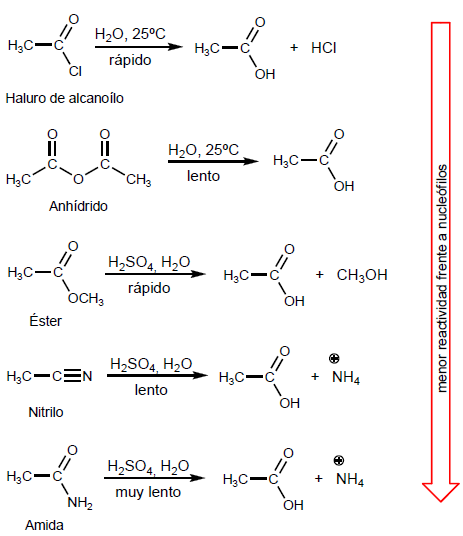
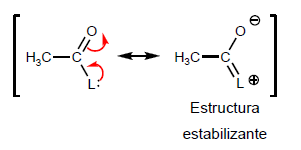
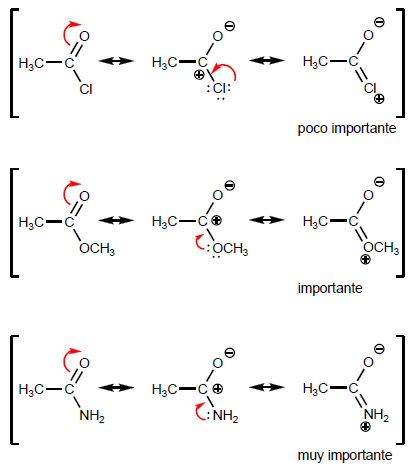
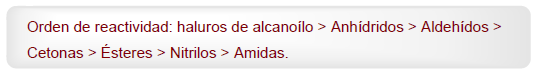
- Detalles
- Germán Fernández
- TEORÍA DE ÁCIDOS CARBOXÍLICOS
- Visto: 30482