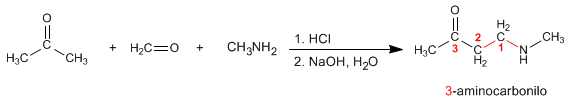THÉORIE DES AMINES
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 142696
Règle 1. Les amines peuvent être désignées comme des dérivés d'alkylamines ou d'alcanoamines. Voyons quelques exemples.
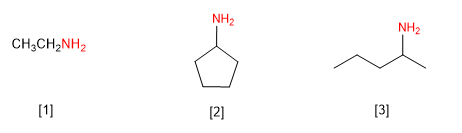
[1] Éthylamine (éthanamine)
[2] Cyclopentylamine (Cyclopentanamine)
[3 ] (Pent-2-yl)amine (Pentan-2-amine)
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 123407
Les amines ont des points de fusion et d'ébullition plus bas que les alcools. Ainsi, l'éthylamine bout à 17 ºC, tandis que le point d'ébullition de l'éthanol est de 78 ºC.
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 76840
Les amines ont des hydrogènes acides sur le groupe amino. Ces hydrogènes peuvent être soustraits à l'aide de bases fortes (organométalliques, hydrures métalliques) formant des amides (bases amines).
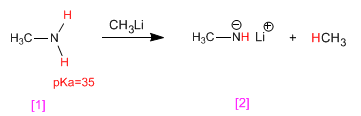
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 75417
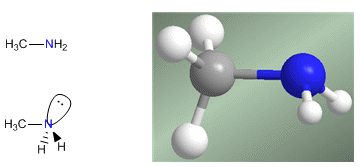
Les amines sont des composés azotés à structure pyramidale, semblable à l'ammoniac. L'azote forme trois liaisons simples à travers des orbitales hybrides sp 3 . La paire isolée occupe la quatrième orbitale avec l'hybridation sp 3 et est responsable du comportement basique et nucléophile des amines.
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 58874
Les amines peuvent être préparées par des réactions de substitution nucléophile entre les haloalcanes et l'ammoniac.
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 58430
Les nitriles peuvent être préparés en faisant réagir des haloalcanes avec du cyanure de sodium. La réduction des nitriles avec LiAlH 4 produit des amines.
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 45106
La réaction des halogénoalcanes primaires et secondaires avec l'azoture de sodium produit des alkylazides qui, par réduction avec LiAlH 4 , donnent naissance à des amides.
Lire la suite : Préparation d'amines par réduction d'azotures
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 44689
Les amides sont réduits avec LiAlH 4 pour former des amines. Le nombre de carbone de l'amine finale est égal à celui de l'amide de départ.
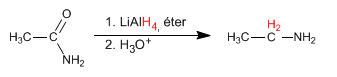
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 43844
Les amides sont transformés en amines, avec un carbone en moins, par traitement au brome en milieu basique. Cette réaction est connue sous le nom de réarrangement d'Hofmann.
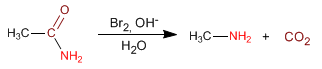
Lire la suite : Synthèse d'amines par réarrangement d'Hofmann
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 62417
La synthèse de Gabriel permet d'obtenir des amines primaires à partir d'haloalcanes, sans formation de mélanges d'amines secondaires et tertiaires.
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 59711
L'amination réductrice consiste à former une imine, à partir d'aldéhydes ou de cétones et d'amines, qui est réduite en amine dans une étape ultérieure. Cette réduction peut être effectuée avec du $H_2$ catalysé par du Nickel ou avec du $NaBH_3CN$.
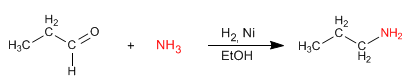
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 36773
Les époxydes (oxacyclopropanes) s'ouvrent par attaque nucléophile, en raison de la déformation importante du cycle. Si le nucléophile utilisé est l'ammoniac, on obtient un β-aminoalcool. Ce type de produit peut également être obtenu en ouvrant l'époxyde avec de l'azoture de sodium, et en réduisant l'azoture dans un second temps.
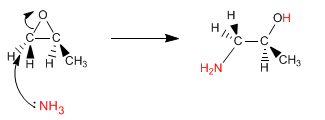
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 68849
L'élimination d'Hofmann permet la conversion des amines en alcènes. C'est une réaction régiosélective qui suit la règle d'Hofmann, formant l'alcène le moins substitué.
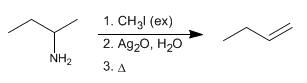
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 45593
L'élimination de Cope permet d'obtenir des alcènes à partir d'amines tertiaires. La réaction consiste à oxyder l'amine tertiaire, formant un N-oxyde d'amine, qui est éliminé intramoléculairement par chauffage, donnant naissance à l'alcène.
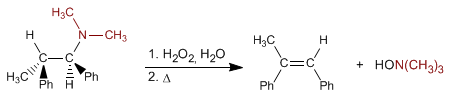
- Détails
- Germán Fernández
- THÉORIE DES AMINES
- Affichages : 52186
Mannich prépare des 3-aminocarbonyles à partir d'amines primaires ou secondaires, de méthane et d'un carbonyle énolisable. Voyons un exemple :