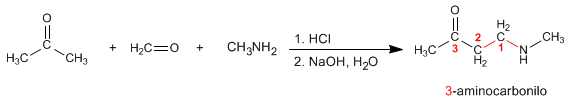AMIN-THEORIE
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 143451
Regel 1. Amine können als Derivate von Alkylaminen oder Alkanoaminen bezeichnet werden. Sehen wir uns einige Beispiele an.
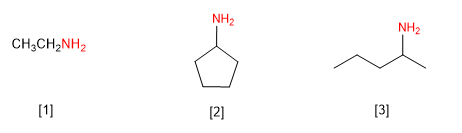
[1] Ethylamin (Ethanamin)
[2] Cyclopentylamin (Cyclopentanamin)
[3] (Pent-2-yl)amin (Pentan-2-amin)
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 122900
Amine haben niedrigere Schmelz- und Siedepunkte als Alkohole. So siedet Ethylamin bei 17 °C, während der Siedepunkt von Ethanol bei 78 °C liegt.
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 76649
Amine haben saure Wasserstoffatome an der Aminogruppe. Diese Wasserstoffe können unter Verwendung starker Basen (organometallische Metallhydride) unter Bildung von Amiden (Aminbasen) subtrahiert werden.
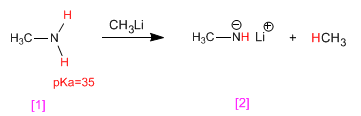
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 75894
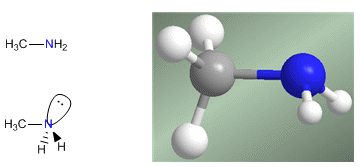
Amine sind stickstoffhaltige Verbindungen mit pyramidenförmiger Struktur, ähnlich wie Ammoniak. Stickstoff bildet über sp 3 -hybridisierte Orbitale drei Einfachbindungen. Das freie Elektronenpaar besetzt das vierte Orbital mit sp 3 -Hybridisierung und ist für das basische und nukleophile Verhalten von Aminen verantwortlich.
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 59531
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 58848
Nitrile können durch Umsetzen von Halogenalkanen mit Natriumcyanid hergestellt werden. Bei der Reduktion von Nitrilen mit LiAlH 4 entstehen Amine.
Weiterlesen: Synthese von Aminen durch Reduktion von Nitrilen
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 45546
Die Reaktion von primären und sekundären Halogenalkanen mit Natriumazid erzeugt Alkylazide, die durch Reduktion mit LiAlH 4 zu Amiden führen.
Weiterlesen: Herstellung von Aminen durch Reduktion von Aziden
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 45270
Amide werden mit LiAlH 4 zu Aminen reduziert. Die Kohlenstoffzahl des Endamins ist gleich der des Ausgangsamids.
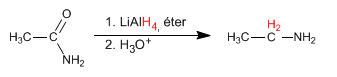
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 43366
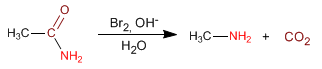
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 60679
Die Gabriel-Synthese ermöglicht die Gewinnung von primären Aminen aus Halogenalkanen, ohne dass Mischungen aus sekundären und tertiären Aminen entstehen.
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 60891
Die reduktive Aminierung besteht darin, aus Aldehyden oder Ketonen und Aminen ein Imin zu bilden, das in einer Folgestufe zu einem Amin reduziert wird. Diese Reduktion kann mit Nickel-katalysiertem $H_2$ oder mit $NaBH_3CN$ durchgeführt werden.
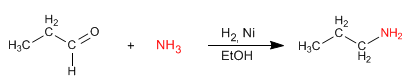
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 38042
Epoxide (Oxacyclopropane) öffnen sich aufgrund der erheblichen Ringspannung durch nukleophilen Angriff. Wird als Nucleophil Ammoniak verwendet, so wird ein β-Aminoalkohol erhalten. Dieser Produkttyp kann auch erhalten werden, indem man das Epoxid mit Natriumazid öffnet und das Azid in einer zweiten Stufe reduziert.
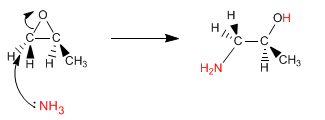
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 65635
Die Hofmann-Eliminierung ermöglicht die Umwandlung von Aminen in Alkene. Es ist eine regioselektive Reaktion, die der Hofmannschen Regel folgt und das am wenigsten substituierte Alken bildet.
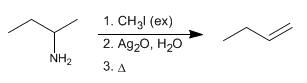
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 44446
Die Cope-Eliminierung ermöglicht es, Alkene aus tertiären Aminen zu erhalten. Die Reaktion besteht aus der Oxidation des tertiären Amins unter Bildung eines Amin-N-oxids, das intramolekular durch Erhitzen eliminiert wird, wodurch das Alken entsteht.
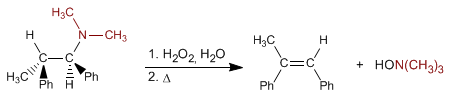
- Details
- Germán Fernández
- AMIN-THEORIE
- Zugriffe: 48756
Mannich stellt 3-Aminocarbonyle aus primären oder sekundären Aminen, Methan und einem enolisierbaren Carbonyl her. Sehen wir uns ein Beispiel an: