TEORI SIKLOALKANA
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 1981
Nomenklatur sikloalkana 
Sikloalkana diberi nama dengan awalan siklo- diikuti dengan nama alkana dengan jumlah karbon yang sama. Sikloalkana menunjukkan isomerisme cis/trans. Ketika substituen berada pada permukaan molekul yang sama, mereka disebut cis; ketika mereka bertemu di sisi yang berlawanan, mereka dikatakan trans.
properti fisik
Mereka memiliki titik leleh dan titik didih yang lebih tinggi daripada alkana yang sesuai dengan jumlah karbon yang sama. Kekakuan cincin memungkinkan lebih banyak interaksi antarmolekul, yang diperlukan untuk menembus masukan energi, untuk meneruskan molekul ke fase gas.
stres annular
Sikloalkana ukuran kecil (siklopropana, siklobutana) menghadirkan tekanan yang signifikan karena sudut ikatan dan gerhana. Sikloalkana yang lebih besar seperti siklopentana dan sikloheksana hampir bebas stres.
Isomer konformasi dalam sikloheksana
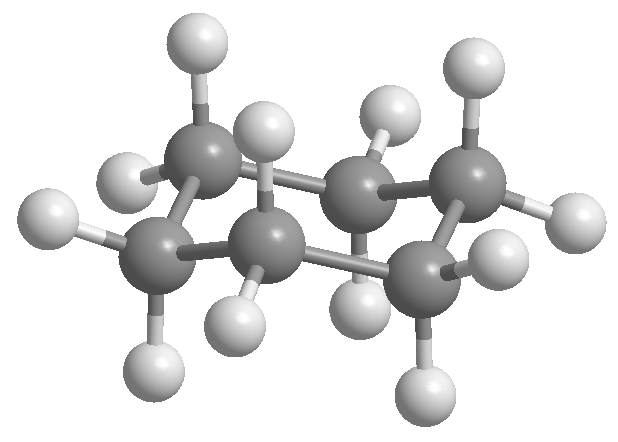
Cyclohexane disusun dalam bentuk kursi untuk menghindari gerhana antar hidrogen. Bentuk kursi sikloheksana mengandung dua jenis hidrogen; yang aksial yang terletak tegak lurus terhadap bidang molekul dan yang ekuator ditempatkan di bidang yang sama.
Kesetimbangan ekuatorial-aksial dalam sikloheksana tersubstitusi
Sikloheksana menghadirkan kesetimbangan konformasi yang saling mengubah hidrogen ekuatorial menjadi hidrogen aksial dan sebaliknya. Ketika sikloheksana disubstitusi, konformasi yang menempatkan sebagian besar gugus pada posisi ekuator adalah yang paling stabil, menemukan kesetimbangan konformasi bergeser ke arah konformasi tersebut.
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 166634
Sikloalkana adalah alkana yang memiliki ujung rantai yang bergabung bersama, membentuk sebuah siklus. Mereka memiliki dua hidrogen lebih sedikit daripada alkana asalnya, itulah sebabnya rumus molekulnya adalah C n H 2n . Mereka diberi nama menggunakan awalan siklo diikuti dengan nama alkana.
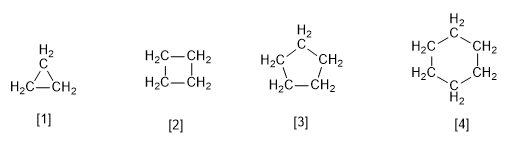
[1] Siklopropana
[2] Siklobutana
[3] Siklopentana
[4] Sikloheksana
Adalah umum untuk mewakili molekul yang hanya menunjukkan kerangka mereka. Setiap simpul mewakili karbon yang terikat pada dua hidrogen. 
Aturan IUPAC untuk penamaan sikloalkana sangat mirip dengan yang dipelajari untuk alkana.
Aturan 1.- Dalam sikloalkana dengan substituen tunggal, siklus diambil sebagai rantai utama molekul. Penomoran siklus tidak diperlukan.
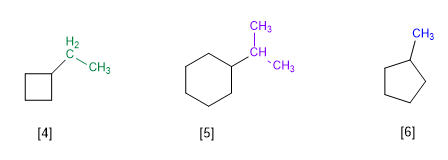
[4] Etilsiklobutana
[5] Isopropilsikloheksana
[6] Metilsiklopentana
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 83157
Di alam, senyawa dengan siklus lima dan enam mata rantai sangat melimpah. Namun, siklus beranggota tiga dan empat sangat jarang muncul dalam produk alami.
Stabilitas dalam sikloalkana
Fakta-fakta eksperimental ini menunjukkan stabilitas yang lebih besar dari siklus lima atau enam anggota sehubungan dengan tiga atau empat.
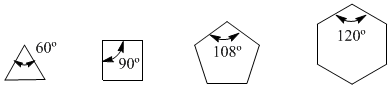
Pada tahun 1885, ahli kimia Jerman Adolf von Baeyer mengusulkan bahwa ketidakstabilan siklus kecil disebabkan oleh tegangan sudut ikatan. Karbon sp 3 memiliki sudut ikatan alami 109,5º, dalam siklopropana sudut ini adalah 60º, yang merupakan deviasi 49,5º. Defleksi ini diterjemahkan menjadi stres, yang menyebabkan ketidakstabilan dalam molekul.
Cyclobutane lebih stabil karena sudut ikatannya 90º dan defleksinya hanya 19,5º. Baeyer menerapkan alasan ini pada sikloalkana lain dan memperkirakan bahwa siklopentana seharusnya lebih stabil daripada sikloheksana.
tegangan sudut
Amati sudut ikatan sikloalkana yang berbeda:
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 71484
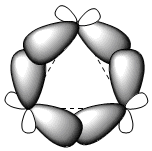 Tiga atom karbon siklopropana terletak pada bidang yang sama, tidak seperti sikloalkana lain yang tidak planar. Siklopropana dicirikan oleh regangan sudut yang besar karena sudut ikatan jauh di bawah 109,5°. Stres luar biasa yang dialami siklus menyebabkan ikatan karbon-karbon melengkung ke luar, sehingga menimbulkan ikatan yang sangat khas yang disebut ikatan "pisang".
Tiga atom karbon siklopropana terletak pada bidang yang sama, tidak seperti sikloalkana lain yang tidak planar. Siklopropana dicirikan oleh regangan sudut yang besar karena sudut ikatan jauh di bawah 109,5°. Stres luar biasa yang dialami siklus menyebabkan ikatan karbon-karbon melengkung ke luar, sehingga menimbulkan ikatan yang sangat khas yang disebut ikatan "pisang".
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 65908
Cyclobutane tidak datar, salah satu karbonnya keluar sekitar 25º dari bidang yang dibentuk oleh tiga karbon lainnya. Susunan ini meningkatkan tegangan sudut, tetapi gerhana hidrogen-hidrogen yang ditunjukkan molekul dalam bentuk planarnya sangat berkurang.
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 52672
Jika siklopentana adalah planar, praktis bebas dari regangan sudut. Tapi itu akan menghadirkan lima hidrogen gerhana untuk setiap wajah, yang akan membuat molekul tidak stabil. Susunan siklopentana yang paling disukai adalah bentuk amplop. Dalam pengaturan ini jumlah tegangan sudut dan gerhana minimal.
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 74288
 Siklus enam adalah yang paling melimpah di alam. Ada banyak senyawa dengan aktivitas biologis yang dasarnya adalah siklus enam atom terkondensasi (kolesterol).
Siklus enam adalah yang paling melimpah di alam. Ada banyak senyawa dengan aktivitas biologis yang dasarnya adalah siklus enam atom terkondensasi (kolesterol).
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 77123
Profesor Odd Hassel dari Universitas Oslo menetapkan bahwa konformasi sikloheksana yang paling stabil adalah bentuk kursi. Dengan sudut ikatan 111º kursi hampir bebas dari ketegangan sudut. Juga, semua tautan terhuyung-huyung seperti yang terlihat pada proyeksi Newman.
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 3602
Sikloheksana menghadirkan kesetimbangan konformasi di mana hidrogen aksial, berwarna merah, bergerak ke posisi ekuatorial. Hidrogen ekuatorial, berwarna hijau, beralih ke posisi aksial.
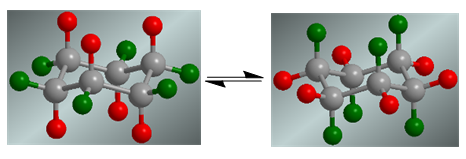
Dengan tidak adanya substituen, kedua konformasi memiliki probabilitas yang sama dan kesetimbangan koformasi tidak bergeser.
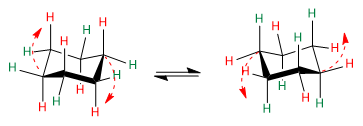
Amati panah merah untuk memahami bagaimana transisi dari satu konformasi ke konformasi lainnya terjadi.
- Detail
- Germán Fernández
- TEORI SIKLOALKANA
- Dilihat: 3547
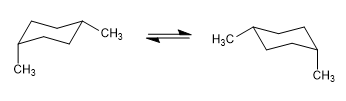
Pada model berikut terlihat bahwa pada konformer ekuatorial gugus metil jauh dari gugus lainnya. Sebaliknya, pada konformer aksial gugus metil tersebut berhadapan dengan hidrogen aksial yang terletak pada posisi 3 terhadapnya. Kedekatan spasial ini menyebabkan tolakan sterik, yang disebut interaksi 1,3-diaxial.
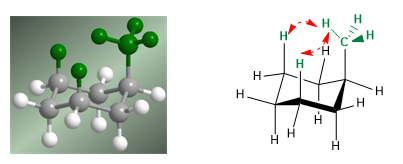
Interaksi 1,3-diaxial menyebabkan pergeseran kesetimbangan konformasi ke kiri. Konformasi di sebelah kanan memiliki energi tinggi karena tolakan antara metil dan hidrogen aksial.
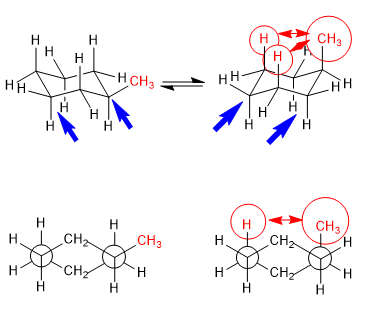
Kesetimbangan dalam trans-1,4-dimethylcyclohexane
Interaksi 1,3-diaxial membuat substituen cenderung berada pada posisi ekuator. Jadi, dalam trans-1,4-Dimethylcyclohexane konformasi dengan dua gugus metil di ekuatorial lebih stabil daripada kursi dengan metil aksial, ini menghasilkan perpindahan kesetimbangan konformasi ke kiri.
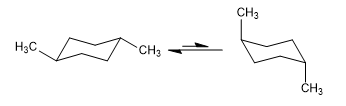
Kesetimbangan dalam cis-1,4-dimethylcyclohexane