ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 1677
Номенклатура циклоалканов 
Циклоалканы называются с приставкой цикло-, за которой следует название алкана с таким же числом атомов углерода. Циклоалканы проявляют цис/транс-изомерию. Когда заместители находятся на одной стороне молекулы, говорят, что они цис; когда они встречаются на противоположных сторонах, их называют трансгендерными.
физические свойства
Они имеют более высокие температуры плавления и кипения, чем соответствующие алканы с таким же числом атомов углерода. Жесткость кольца позволяет большее количество межмолекулярных взаимодействий, которые необходимо оборвать за счет ввода энергии, для перехода молекул в газовую фазу.
кольцевое напряжение
Циклоалканы небольшого размера (циклопропан, циклобутан) представляют значительное напряжение из-за валентных углов и затмения. Более крупные циклоалканы, такие как циклопентан и циклогексан, почти не подвержены стрессу.
Конформационные изомеры в циклогексане
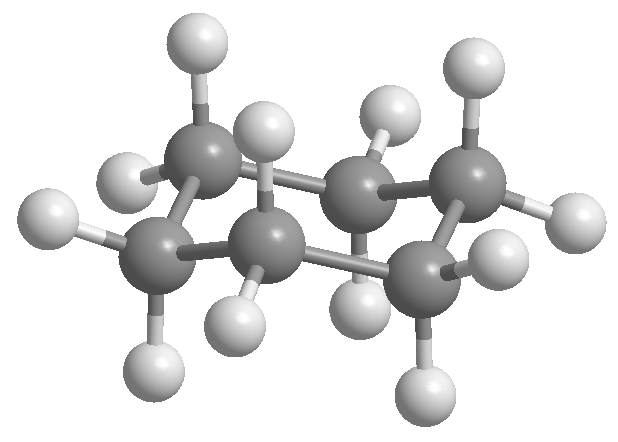
Циклогексан расположен в виде стула, чтобы избежать затмения между атомами водорода. Форма кресла циклогексана содержит два типа атомов водорода; аксиальные, расположенные перпендикулярно плоскости молекулы, и экваториальные, расположенные в той же плоскости.
Экваториально-аксиальное равновесие в замещенных циклогексанах
Циклогексан представляет собой конформационное равновесие, которое взаимопревращает экваториальные атомы водорода в аксиальные и наоборот. Когда циклогексан замещен, конформация, которая помещает большинство групп в экваториальное положение, является наиболее стабильной, обнаруживая, что конформационное равновесие смещено в сторону указанной конформации.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 166047
Циклоалканы — это алканы, у которых концы цепи соединены вместе, образуя цикл. В них на два атома водорода меньше , чем в алкане, из которого они получены, поэтому их молекулярная формула CnH2n . Они названы с использованием префикса цикло, за которым следует название алкана.
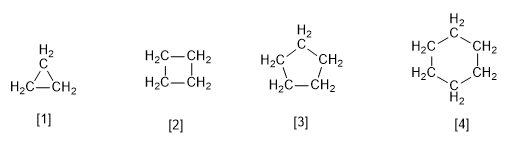
[1] Циклопропан
[2] Циклобутан
[3] Циклопентан
[4] Циклогексан
Молекулы принято представлять, указывая только их скелет. Каждая вершина представляет собой углерод, связанный с двумя атомами водорода. 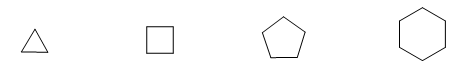
Правила ИЮПАК для обозначения циклоалканов очень похожи на правила, изученные для алканов.
Правило 1.- В циклоалканах с одним заместителем за основную цепь молекулы принимается цикл. Циклическая нумерация не нужна.
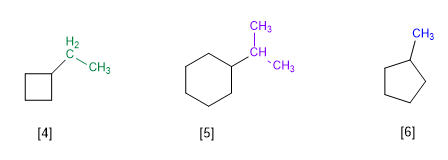
[4] Этилциклобутан
[5] Изопропилциклогексан
[6] Метилциклопентан
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 81879
В природе очень распространены соединения с циклами из пяти и шести звеньев. Однако трех- и четырехчленные циклы в природных продуктах встречаются очень редко.
Стабильность в циклоалканах
Эти экспериментальные факты свидетельствуют о большей стабильности циклов пяти или шести членов по сравнению с циклами трех или четырех.
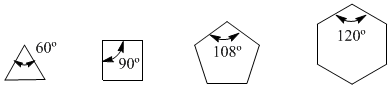
В 1885 году немецкий химик Адольф фон Байер предположил, что нестабильность малых циклов связана с напряжением валентных углов. У атомов углерода sp 3 естественные валентные углы составляют 109,5º, у циклопропана эти углы равны 60º, что является отклонением в 49,5º. Это отклонение преобразуется в напряжение, вызывающее нестабильность молекулы.
Циклобутан более стабилен, поскольку его валентные углы составляют 90º, а отклонение составляет всего 19,5º. Байер применил это рассуждение к другим циклоалканам и предсказал, что циклопентан должен быть более стабильным, чем циклогексан.
угловое напряжение
Обратите внимание на валентные углы различных циклоалканов:
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 71604
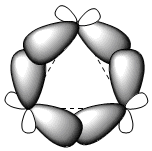 Три атома углерода циклопропана лежат в одной плоскости, в отличие от других циклоалканов, которые не являются плоскими. Циклопропан характеризуется большой угловой деформацией из-за валентных углов значительно ниже 109,5°. Огромное напряжение, которому подвергается цикл, заставляет углерод-углеродные связи изгибаться наружу, создавая очень характерные связи, называемые «банановыми» связями.
Три атома углерода циклопропана лежат в одной плоскости, в отличие от других циклоалканов, которые не являются плоскими. Циклопропан характеризуется большой угловой деформацией из-за валентных углов значительно ниже 109,5°. Огромное напряжение, которому подвергается цикл, заставляет углерод-углеродные связи изгибаться наружу, создавая очень характерные связи, называемые «банановыми» связями.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 66250
Циклобутан не плоский, один из его атомов углерода выходит примерно на 25º из плоскости, образованной тремя другими атомами углерода. Такое расположение увеличивает угловое напряжение, но водородно-водородное затмение, которое молекула представляет в своей плоской форме, значительно уменьшается.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 52037
Если бы циклопентан был плоским, он был бы практически свободен от угловой деформации. Но это будет представлять пять затменных водородов для каждой грани, что дестабилизирует молекулу. Наиболее выгодным расположением циклопентана является оболочечная форма. При таком расположении сумма угловых напряжений и затмения минимальна.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 73506
 Циклы из шести наиболее распространены в природе. Существует много соединений с биологической активностью, основу которых составляют циклы из шести конденсированных атомов (холестерин).
Циклы из шести наиболее распространены в природе. Существует много соединений с биологической активностью, основу которых составляют циклы из шести конденсированных атомов (холестерин).
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 74069
Профессор Одд Хассель из Университета Осло установил, что наиболее стабильной конформацией циклогексана является форма кресла. При валентных углах 111º кресло почти не подвержено угловому напряжению. Кроме того, все ссылки расположены в шахматном порядке, как это видно в проекции Ньюмана.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 2681
Циклогексан представляет собой конформационное равновесие, при котором аксиальные атомы водорода, отмеченные красным, перемещаются в экваториальное положение. Экваториальные атомы водорода, отмеченные зеленым, поворачиваются в осевое положение.
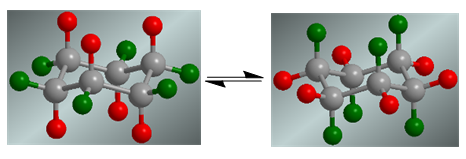
В отсутствие заместителей обе конформации имеют одинаковую вероятность существования и коформационное равновесие не смещается.
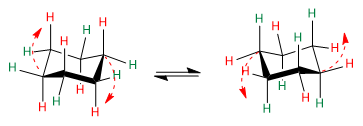
Наблюдайте за красными стрелками, чтобы понять, как происходит переход от одной конформации к другой.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ЦИКЛОАЛКАНОВ
- Просмотров: 3969
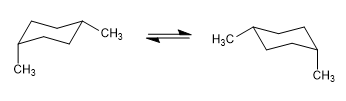
На следующей модели видно, что в экваториальном конформере метильная группа находится далеко от остальных групп. Наоборот, в аксиальном конформере указанная метильная группа обращена к аксиальным атомам водорода, которые находятся в положении 3 по отношению к ней. Эта пространственная близость вызывает стерическое отталкивание, называемое 1,3-диаксиальным взаимодействием.
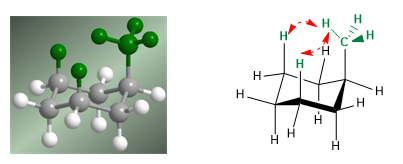
1,3-диаксиальное взаимодействие вызывает сдвиг конформационного равновесия влево. Конформация справа имеет высокую энергию из-за отталкивания между метильным и аксиальным атомами водорода.
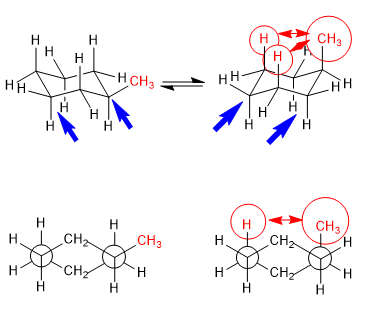
Равновесие в транс-1,4-диметилциклогексане
1,3-диаксиальные взаимодействия заставляют заместители располагаться в экваториальных положениях. Так, в транс-1,4-диметилциклогексане конформация с двумя метильными группами в экваториальном положении более устойчива, чем кресло с аксиальными метилами, что приводит к смещению конформационного равновесия влево.
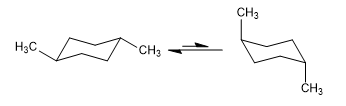
Равновесие в цис-1,4-диметилциклогексане