THÉORIE DES CYCLOALCANES
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 2098
Nomenclature des cycloalcanes 
Les cycloalcanes sont nommés avec le préfixe cyclo- suivi du nom de l'alcane avec le même nombre de carbones. Les cycloalcanes présentent une isomérie cis/trans. Lorsque les substituants sont sur la même face de la molécule, on dit qu'ils sont cis ; lorsqu'ils se rencontrent de part et d'autre, on dit qu'ils sont trans.
Propriétés physiques
Ils ont des points de fusion et d'ébullition plus élevés que les alcanes correspondants du même nombre de carbones. La rigidité de l'anneau permet un plus grand nombre d'interactions intermoléculaires, qu'il est nécessaire de rompre grâce à l'apport d'énergie, pour faire passer les molécules en phase gazeuse.
contrainte annulaire
Les cycloalcanes de petite taille (cyclopropane, cyclobutane) présentent des contraintes importantes dues aux angles de liaison et aux éclipses. Les cycloalcanes plus gros tels que le cyclopentane et le cyclohexane sont presque sans stress.
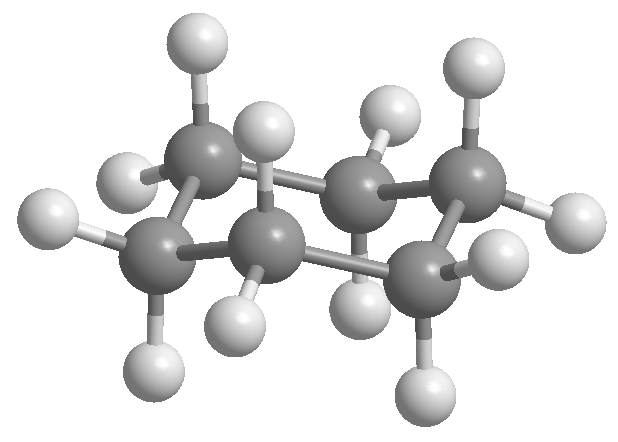
Isomères conformationnels dans le cyclohexane
Le cyclohexane est disposé sous la forme d'une chaise pour éviter les éclipses entre les hydrogènes. La forme chaise du cyclohexane contient deux types d'hydrogènes; les axiales qui sont situées perpendiculairement au plan de la molécule et les équatoriales placées dans le même plan.
Équilibre équatorial-axial dans les cyclohexanes substitués
Le cyclohexane présente un équilibre conformationnel qui interconvertit les hydrogènes équatoriaux en axiaux et vice versa. Lorsqu'un cyclohexane est substitué, la conformation qui place le plus de groupes en position équatoriale est la plus stable, trouvant l'équilibre conformationnel décalé vers ladite conformation.
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 165544
Les cycloalcanes sont des alcanes dont les extrémités de chaîne sont jointes, formant un cycle. Ils ont deux hydrogènes de moins que l'alcane dont ils sont dérivés, c'est pourquoi leur formule moléculaire est C n H 2n . Ils sont nommés à l'aide du préfixe cyclo suivi du nom de l'alcane.
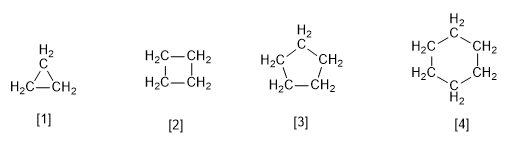
[1] Cyclopropane
[2] Cyclobutane
[3] Cyclopentane
[4] Cyclohexane
Il est courant de représenter des molécules en indiquant uniquement leur squelette. Chaque sommet représente un carbone lié à deux hydrogènes. 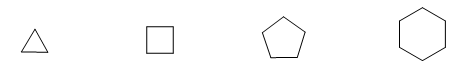
Les règles IUPAC pour nommer les cycloalcanes sont très similaires à celles étudiées pour les alcanes.
Règle 1.- Dans les cycloalcanes à un seul substituant, le cycle est pris comme chaîne principale de la molécule. La numérotation des cycles est inutile.
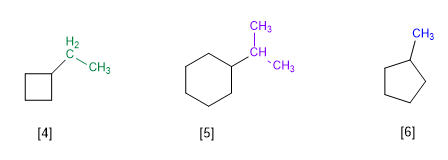
[4] Éthylcyclobutane
[5] Isopropylcyclohexane
[6] Méthylcyclopentane
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 82413
Dans la nature, les composés avec des cycles de cinq et six maillons sont très abondants. Cependant, les cycles à trois et quatre chaînons apparaissent très rarement dans les produits naturels.
Stabilité dans les cycloalcanes
Ces faits expérimentaux suggèrent la plus grande stabilité des cycles de cinq ou six membres par rapport à ceux de trois ou quatre.
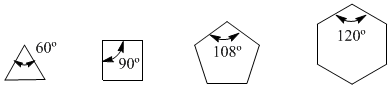
En 1885, le chimiste allemand Adolf von Baeyer a proposé que l'instabilité des petits cycles était due à la tension des angles de liaison. Les carbones sp 3 ont des angles de liaison naturels de 109,5º, dans le cyclopropane ces angles sont de 60º, soit un écart de 49,5º. Cette déviation se traduit par un stress, qui provoque une instabilité dans la molécule.
Le cyclobutane est plus stable car ses angles de liaison sont de 90º et la déviation n'est que de 19,5º. Baeyer a appliqué ce raisonnement aux autres cycloalcanes et a prédit que le cyclopentane devrait être plus stable que le cyclohexane.
contrainte angulaire
Observez les angles de liaison des différents cycloalcanes :
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 71065
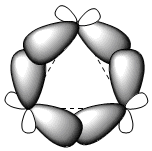 Les trois atomes de carbone du cyclopropane se trouvent dans le même plan, contrairement aux autres cycloalcanes qui ne sont pas plans. Le cyclopropane est caractérisé par une grande déformation angulaire due à des angles de liaison bien inférieurs à 109,5°. L'énorme contrainte à laquelle le cycle est soumis fait plier les liaisons carbone-carbone vers l'extérieur, donnant naissance à des liaisons très caractéristiques dites "bananes".
Les trois atomes de carbone du cyclopropane se trouvent dans le même plan, contrairement aux autres cycloalcanes qui ne sont pas plans. Le cyclopropane est caractérisé par une grande déformation angulaire due à des angles de liaison bien inférieurs à 109,5°. L'énorme contrainte à laquelle le cycle est soumis fait plier les liaisons carbone-carbone vers l'extérieur, donnant naissance à des liaisons très caractéristiques dites "bananes".
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 65402
Le cyclobutane n'est pas plat, un de ses carbones sort à environ 25º du plan formé par les trois autres carbones. Cette disposition augmente la tension angulaire, mais l'éclipse hydrogène-hydrogène que présente la molécule sous sa forme plane est considérablement réduite.
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 52100
Si le cyclopentane était plan, il serait pratiquement exempt de déformation angulaire. Mais il présenterait cinq hydrogènes éclipsés pour chaque face, ce qui déstabiliserait la molécule. La disposition la plus favorable du cyclopentane est la forme enveloppe. Dans cet agencement, la somme des contraintes angulaires et de l'éclipse est minimale.
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 73964
 Les cycles de six sont les plus abondants dans la nature. Il existe de nombreux composés à activité biologique dont la base sont des cycles de six atomes condensés (cholestérol).
Les cycles de six sont les plus abondants dans la nature. Il existe de nombreux composés à activité biologique dont la base sont des cycles de six atomes condensés (cholestérol).
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 73962
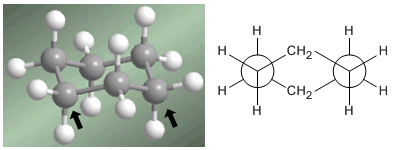
Le professeur Odd Hassel de l'Université d'Oslo a établi que la conformation la plus stable du cyclohexane est la forme chaise. Avec des angles de liaison de 111º, la chaise est presque exempte de tension angulaire. De plus, tous les liens sont décalés comme on peut le voir dans la projection de Newman.
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 2885
Le cyclohexane présente un équilibre conformationnel dans lequel les hydrogènes axiaux, en rouge, se déplacent vers la position équatoriale. Les hydrogènes équatoriaux, en vert, tournent vers la position axiale.
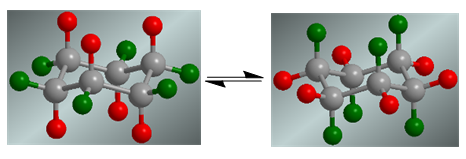
En l'absence de substituants, les deux conformations ont la même probabilité d'exister et l'équilibre coformationnel n'est pas déplacé.
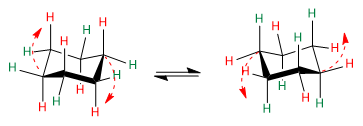
Observez les flèches rouges pour comprendre comment s'effectue le passage d'une conformation à une autre.
- Détails
- Germán Fernández
- THÉORIE DES CYCLOALCANES
- Affichages : 4963
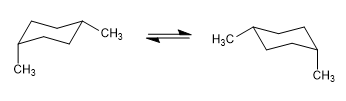
Dans le modèle suivant, on peut voir que dans le conformère équatorial, le groupe méthyle est éloigné du reste des groupes. Au contraire, dans le conformateur axial, ledit groupe méthyle fait face aux hydrogènes axiaux qui sont situés en position 3 par rapport à lui. Cette proximité spatiale provoque une répulsion stérique, appelée interaction 1,3-diaxiale.
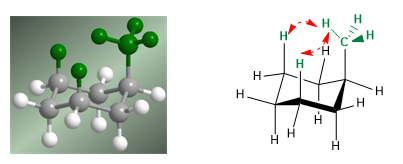
L'interaction 1,3-diaxiale provoque un déplacement de l'équilibre conformationnel vers la gauche. La conformation de droite a une énergie élevée due à la répulsion entre les hydrogènes méthyle et axial.
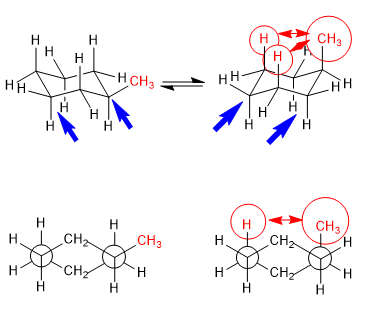
Équilibre en trans-1,4-diméthylcyclohexane
Les interactions 1,3-diaxiales font que les substituants ont tendance à être situés dans des positions équatoriales. Ainsi, dans le trans-1,4-Diméthylcyclohexane la conformation avec les deux groupements méthyle en équatorial est plus stable que la chaise avec les méthyles axiaux, cela produit un déplacement de l'équilibre conformationnel vers la gauche.
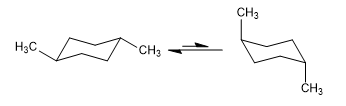
Équilibre en cis-1,4-diméthylcyclohexane