THEORIE DER CYCLOALKANES
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 1745
Cycloalkane-Nomenklatur 
Cycloalkane werden mit dem Präfix cyclo- gefolgt vom Namen des Alkans mit der gleichen Anzahl an Kohlenstoffatomen benannt. Cycloalkane zeigen cis/trans-Isomerie. Wenn sich die Substituenten auf der gleichen Seite des Moleküls befinden, werden sie als cis bezeichnet; Wenn sie sich auf gegenüberliegenden Seiten treffen, werden sie als trans bezeichnet.
physikalische Eigenschaften
Sie haben höhere Schmelz- und Siedepunkte als die entsprechenden Alkane mit der gleichen Kohlenstoffzahl. Die Starrheit des Rings ermöglicht eine größere Anzahl intermolekularer Wechselwirkungen, die durch Energiezufuhr durchbrochen werden müssen, um die Moleküle in die Gasphase zu überführen.
Ringspannung
Kleine Cycloalkane (Cyclopropan, Cyclobutan) weisen aufgrund von Bindungswinkeln und Verdunklung erhebliche Spannungen auf. Größere Cycloalkane wie Cyclopentan und Cyclohexan sind nahezu stressfrei.
Konformationsisomere in Cyclohexan
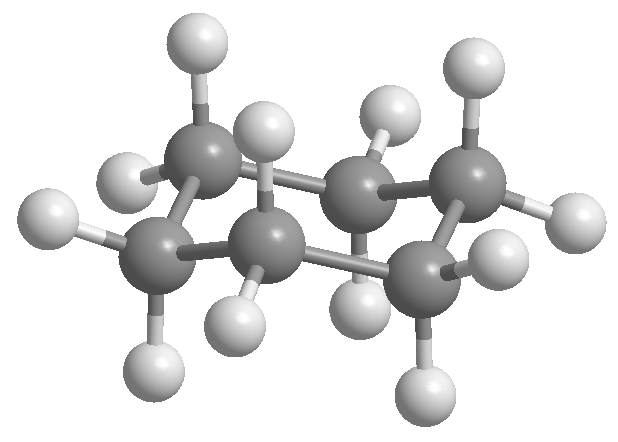
Cyclohexan ist in Form eines Stuhls angeordnet, um eine Verdunklung zwischen Wasserstoffatomen zu vermeiden. Die Stuhlform von Cyclohexan enthält zwei Arten von Wasserstoffatomen; die axialen, die senkrecht zur Ebene des Moleküls angeordnet sind, und die äquatorialen, die in derselben Ebene angeordnet sind.
Äquatorialaxiales Gleichgewicht in substituierten Cyclohexanen
Cyclohexan stellt ein Konformationsgleichgewicht dar, das äquatoriale Wasserstoffatome in axiale umwandelt und umgekehrt. Wenn ein Cyclohexan substituiert wird, ist die Konformation, die die meisten Gruppen in der äquatorialen Position platziert, die stabilste, wobei festgestellt wird, dass das Konformationsgleichgewicht in Richtung dieser Konformation verschoben ist.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 166349
Cycloalkane sind Alkane, bei denen die Kettenenden miteinander verbunden sind und einen Zyklus bilden. Sie haben zwei Wasserstoffatome weniger als das Alkan, von dem sie abgeleitet sind, weshalb ihre Summenformel CnH2n lautet. Sie werden mit dem Präfix Cyclo, gefolgt vom Namen des Alkans, benannt.
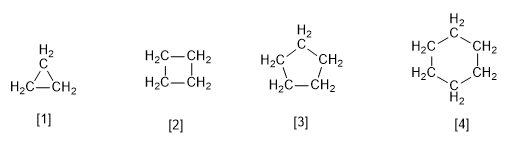
[1] Cyclopropan
[2] Cyclobutan
[3] Cyclopentan
[4] Cyclohexan
Es ist üblich, Moleküle darzustellen, die nur ihr Skelett angeben. Jeder Scheitelpunkt stellt einen Kohlenstoff dar, der an zwei Wasserstoffatome gebunden ist. 
Die IUPAC-Regeln zur Benennung von Cycloalkanen sind denen sehr ähnlich, die für Alkane untersucht wurden.
Regel 1.- Bei Cycloalkanen mit einem einzigen Substituenten wird der Zyklus als Hauptkette des Moleküls angesehen. Eine Zyklennummerierung ist nicht erforderlich.
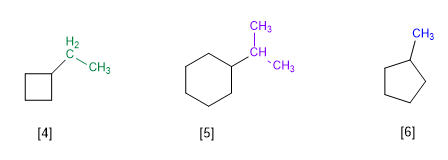
[4] Ethylcyclobutan
[5] Isopropylcyclohexan
[6] Methylcyclopentan
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 82728
In der Natur kommen Verbindungen mit Zyklen von fünf und sechs Gliedern sehr häufig vor. Allerdings treten die drei- und viergliedrigen Kreisläufe in Naturprodukten sehr selten auf.
Stabilität in Cycloalkanen
Diese experimentellen Tatsachen deuten auf die größere Stabilität der Zyklen von fünf oder sechs Mitgliedern im Vergleich zu denen von drei oder vier hin.
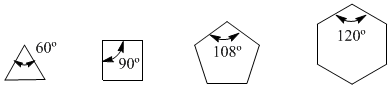
Im Jahr 1885 schlug der deutsche Chemiker Adolf von Baeyer vor, dass die Instabilität kleiner Zyklen auf die Spannung der Bindungswinkel zurückzuführen sei. Die sp 3 -Kohlenstoffe haben natürliche Bindungswinkel von 109,5°, in Cyclopropan betragen diese Winkel 60°, was einer Abweichung von 49,5° entspricht. Diese Auslenkung führt zu Stress, der das Molekül instabil macht.
Cyclobutan ist stabiler, da seine Bindungswinkel 90º betragen und die Durchbiegung nur 19,5º beträgt. Baeyer wandte diese Argumentation auf die anderen Cycloalkane an und sagte voraus, dass Cyclopentan stabiler sein sollte als Cyclohexan.
Winkelspannung
Beachten Sie die Bindungswinkel der verschiedenen Cycloalkane:
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 70985
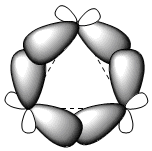 Die drei Kohlenstoffatome von Cyclopropan liegen im Gegensatz zu den anderen Cycloalkanen, die nicht planar sind, in derselben Ebene. Cyclopropan ist durch eine große Winkeldehnung aufgrund von Bindungswinkeln weit unter 109,5° gekennzeichnet. Die enorme Belastung, der der Kreislauf ausgesetzt ist, bewirkt, dass sich die Kohlenstoff-Kohlenstoff-Bindungen nach außen biegen, wodurch sehr charakteristische Bindungen entstehen, die als "Bananen" -Bindungen bezeichnet werden.
Die drei Kohlenstoffatome von Cyclopropan liegen im Gegensatz zu den anderen Cycloalkanen, die nicht planar sind, in derselben Ebene. Cyclopropan ist durch eine große Winkeldehnung aufgrund von Bindungswinkeln weit unter 109,5° gekennzeichnet. Die enorme Belastung, der der Kreislauf ausgesetzt ist, bewirkt, dass sich die Kohlenstoff-Kohlenstoff-Bindungen nach außen biegen, wodurch sehr charakteristische Bindungen entstehen, die als "Bananen" -Bindungen bezeichnet werden.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 65909
Cyclobutan ist nicht flach, einer seiner Kohlenstoffe steht etwa 25º von der Ebene heraus, die von den anderen drei Kohlenstoffen gebildet wird. Diese Anordnung erhöht die Winkelspannung, aber die Wasserstoff-Wasserstoff-Verdunklung, die das Molekül in seiner planaren Form darstellt, wird erheblich reduziert.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 51978
Wenn Cyclopentan planar wäre, wäre es praktisch frei von Winkelspannungen. Aber es würde fünf verdunkelte Wasserstoffatome für jede Seite präsentieren, was das Molekül destabilisieren würde. Die günstigste Anordnung von Cyclopentan ist die Hüllenform. Bei dieser Anordnung ist die Summe aus Winkelspannungen und Überdeckung minimal.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 73968
 Sechserzyklen kommen in der Natur am häufigsten vor. Es gibt viele Verbindungen mit biologischer Aktivität, deren Basis Zyklen aus sechs kondensierten Atomen (Cholesterin) sind.
Sechserzyklen kommen in der Natur am häufigsten vor. Es gibt viele Verbindungen mit biologischer Aktivität, deren Basis Zyklen aus sechs kondensierten Atomen (Cholesterin) sind.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 74642
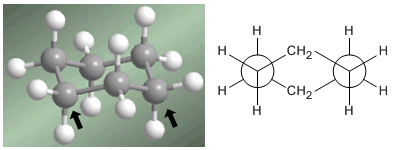
Professor Odd Hassel von der Universität Oslo stellte fest, dass die stabilste Konformation von Cyclohexan die Stuhlform ist. Mit Bindungswinkeln von 111º ist der Stuhl nahezu winkelspannungsfrei. Außerdem sind alle Verbindungen versetzt, wie in der Newman-Projektion zu sehen ist.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 2319
Cyclohexan stellt ein Konformationsgleichgewicht dar, in dem sich die axialen Wasserstoffatome in Rot in die äquatoriale Position bewegen. Die äquatorialen Wasserstoffatome in Grün drehen sich in die axiale Position.
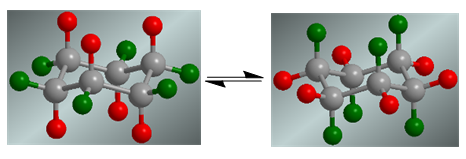
In Abwesenheit von Substituenten haben beide Konformationen die gleiche Existenzwahrscheinlichkeit und das Koformationsgleichgewicht wird nicht verschoben.
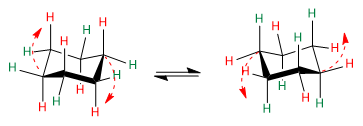
Beachten Sie die roten Pfeile, um zu verstehen, wie der Übergang von einer Konformation zur anderen stattfindet.
- Details
- Germán Fernández
- THEORIE DER CYCLOALKANES
- Zugriffe: 5539
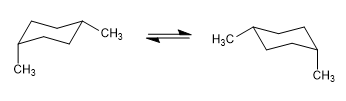
Im folgenden Modell ist ersichtlich, dass im äquatorialen Konformer die Methylgruppe weit von den übrigen Gruppen entfernt ist. Im Gegensatz dazu ist diese Methylgruppe im axialen Konformer den axialen Wasserstoffatomen zugewandt, die sich in Bezug auf sie in Position 3 befinden. Diese räumliche Nähe verursacht eine sterische Abstoßung, die als 1,3-diaxiale Wechselwirkung bezeichnet wird.
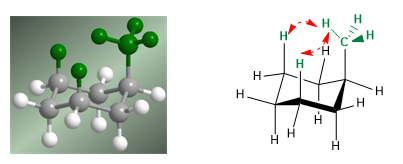
Die 1,3-diaxiale Wechselwirkung bewirkt eine Verschiebung des Konformationsgleichgewichts nach links. Die rechte Konformation hat aufgrund der Abstoßung zwischen Methyl und axialen Wasserstoffatomen eine hohe Energie.
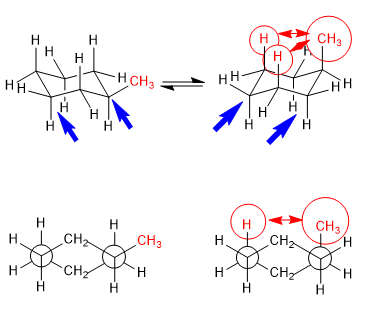
Gleichgewicht in trans-1,4-Dimethylcyclohexan
Die 1,3-diaxialen Wechselwirkungen führen dazu, dass die Substituenten dazu neigen, sich in äquatorialen Positionen zu befinden. So ist in trans-1,4-Dimethylcyclohexan die Konformation mit den beiden äquatorialen Methylgruppen stabiler als die Konformation mit axialen Methylgruppen, dies erzeugt eine Verschiebung des Konformationsgleichgewichts nach links.
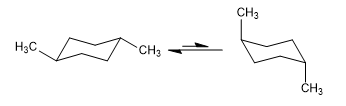
Gleichgewicht in cis-1,4-Dimethylcyclohexan