Wie wir im vorherigen Punkt gesehen haben, haben terminale Alkine saure Wasserstoffatome, die durch starke Basen entfernt werden können, wodurch Acetylide (konjugierte Base des Alkins) gebildet werden. Acetylide sind gute Nucleophile und liefern Mechanismen der nucleophilen Substitution mit primären Substraten.
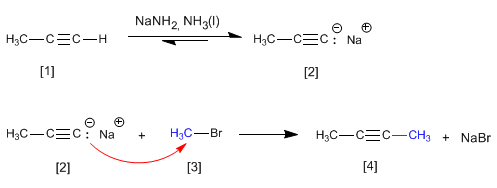
Propin reagiert mit Natriumamid in flüssigem Ammoniak zu Propinylnatrium. In der zweiten Stufe greift Natriumpropinyl als Nucleophil Methylbromid an, um 2-Butin zu bilden. Bei dieser Reaktion wird das Alkin alkyliert und bildet eine Kohlenstoff-Kohlenstoff-Bindung, die die Größe der Kohlenstoffkette erhöht.
Die Bildung von Kohlenstoff-Kohlenstoff-Bindungen ist von großer Bedeutung in der organischen Synthese, da sie den Aufbau großer Moleküle aus kleineren ermöglicht.
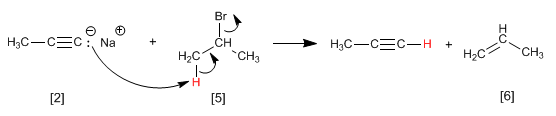
Die Alkylierungsreaktion kann nur mit primären Halogenalkanen durchgeführt werden. So erzeugt Isopropylbromid (sekundäres Substrat) Propen durch Reaktion mit Propinylnatrium über den E2-Mechanismus.
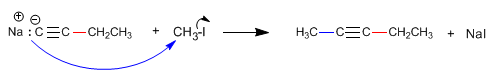
Beispiel: Erhalte 2-Pentin aus Acetylen
Schritt 1. Deprotonierung von Acetylen mit Natriumamid
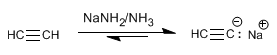
Schritt 2. Alkylierung mit Ethyliodid
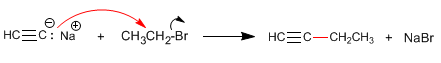
Schritt 3. Deprotonierung von 1-Butin
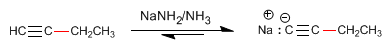
Schritt 4. Alkylierung von 1-Butinylnatrium mit Methyliodid