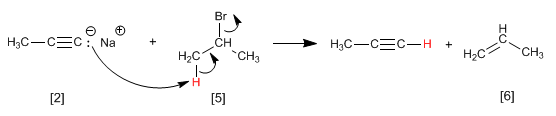
Comme nous l'avons vu au point précédent, les alcynes terminaux ont des hydrogènes acides qui peuvent être éliminés par des bases fortes, formant des acétylures (base conjuguée de l'alcyne). Les acétylures sont de bons nucléophiles et donnent des mécanismes de substitution nucléophile avec des substrats primaires.
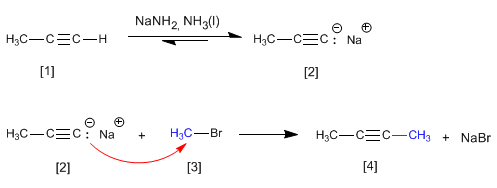
Le propyne réagit avec l'amidure de sodium dans l'ammoniac liquide pour former du propynyl sodium. Dans la deuxième étape, le propynyle de sodium attaque le bromure de méthyle en tant que nucléophile pour former du 2-butyne. Dans cette réaction, l'alcyne est alkylé, formant une liaison carbone-carbone qui augmente la taille de la chaîne carbonée.
La formation de liaisons carbone-carbone est d'une grande importance dans la synthèse organique, permettant la construction de grosses molécules à partir de plus petites.
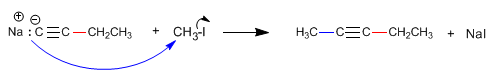
La réaction d'alkylation ne peut être réalisée qu'avec des haloalcanes primaires. Ainsi, le bromure d'isopropyle (substrat secondaire) génère du propène par réaction avec le propynyl sodium, via le mécanisme E2.
Exemple : Obtenir du 2-pentyne à partir d'acétylène
Étape 1. Déprotonation de l'acétylène avec de l'amidure de sodium
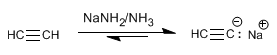
Étape 2. Alkylation avec de l'iodure d'éthyle
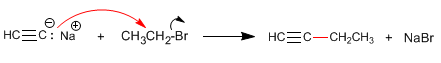
Étape 3. Déprotonation du 1-Butyne
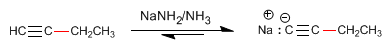
Étape 4. Alkylation du 1-butynyl sodium avec de l'iodure de méthyle