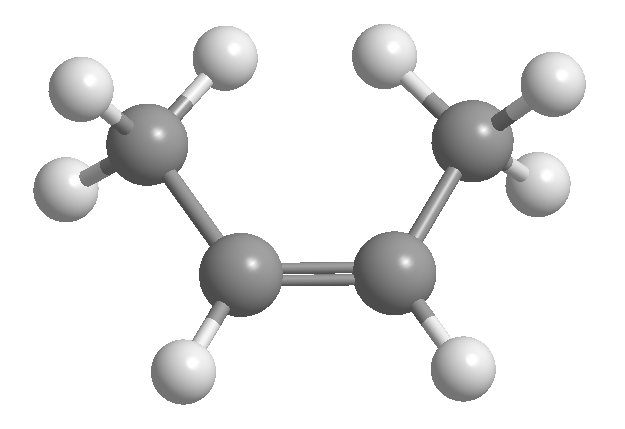
L'isomérie cis-trans ou géométrique est due à une rotation restreinte autour d'une liaison carbone-carbone. Cette restriction peut être due à la présence de doubles liaisons ou de cycles. Ainsi, le 2-butène peut exister sous la forme de deux isomères, appelés cis et trans. L'isomère avec les hydrogènes du même côté est appelé cis, et celui avec les côtés opposés est appelé trans.

[1] cis -2-butène
[2] trans -2-butène
Les composés cycliques, en raison de leur rigidité, présentent également une isomérie géométrique. Ainsi, le 1,2-diméthylcyclohexane peut exister sous forme de deux isomères. Celui avec les hydrogènes du même côté s'appelle l'isomère cis et celui avec les hydrogènes sur les côtés opposés s'appelle le trans. 
[3] cis -1,2-diméthylcyclohexane
[4] trans -1,2-diméthylcyclohexane

[5] trans -2-hexène
[6] cis -2-hexène
![]() Notez que la notation cis/trans est écrite en italique minuscule. En écriture manuscrite, les italiques sont remplacés par du souligné.
Notez que la notation cis/trans est écrite en italique minuscule. En écriture manuscrite, les italiques sont remplacés par du souligné.