¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
TEORÍA DE ESTEREOQUÍMICA
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 5428
Definición de isómero
Se llaman isómeros a aquellas moléculas que poseen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estereoisómeros.
Isómeros estructurales
Los isómeros estructurales difieren en la forma de unir los átomos y a su vez se clasifican en isómeros de cadena de posición y de función.
Estereoisómeros
Los estereoisómeros tienen todos los enlaces idénticos y se diferencian por la disposición espacial de los grupos. Se clasifican en isómeros cis - trans o geométricos, enantiómeros y diastereoisómeros.
Centro quiral o asimétrico
Se llama centro quiral o asimétrico a un átomo unido a cuatro sustituyentes diferentes. Una molécula que posee un centro quiral tiene una imagen especular no superponible con ella, denominada enantiómero.
Actividad óptica
Los enantiómeros poseen casi todas las propiedades físicas idénticas, con la excepción de la actividad óptica. Uno de los enantiómeros produce rotación de la luz polarizada a la derecha (dextrógiro) y el otro rota la luz polarizada a la izquierda (levógiro).
Estereoquímica en reacciones
Las reacciones de halogenación radicalaria sobre moléculas en las que puedan formarse centros quirales producen mezclas de enantiómeros en igual cantidad o de diastereoisómeros en distinta proporción.
Separación de enantiómeros
Los enantiómeros tienen casi todas las propiedades físicas iguales, difieren en la rotación de la luz polarizada, pero poseen el mismo punto de fusión y ebullición e idéntica solubilidad. Por tanto, no les podemos aplicar los metodos tradicionales de separación y hay que recurrir a técnicas especiales. La separación vía diastereoisómeros, consiste en transformar la mezcla de enantiomeros en mezcla de diastereoisómeros por adición de un reactivo quiral, los diastereoisómeros son fácilmente separables por métodos físicos.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 126833
La estereoquímica es el estudio de los compuestos orgánicos en el espacio. Para comprender las propiedades de los compuestos orgánicos es necesario considerar las tres dimensiones espaciales. 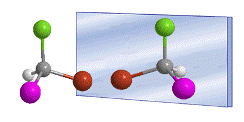 Las bases de la estereoquímica fueron puestas por Jacobus van’t Hoff y Le Bel, en el año 1874. De forma independiente propusieron que los cuatro sustituyentes de un carbono se dirigen hacia los vértices de un tetraedro, con el carbono en el centro del mismo.
Las bases de la estereoquímica fueron puestas por Jacobus van’t Hoff y Le Bel, en el año 1874. De forma independiente propusieron que los cuatro sustituyentes de un carbono se dirigen hacia los vértices de un tetraedro, con el carbono en el centro del mismo.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 375566
Los isómeros son moléculas que tienen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estereoisómeros. Los isómeros estructurales difieren en la forma de unión de sus átomos y se clasifican en isómeros de cadena, posición y función. Como ejemplo, dibujemos los isómeros estructurales de fórmula C2H6O .

[1 ] Etanol
[2 ] Dimetil éter
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 444897
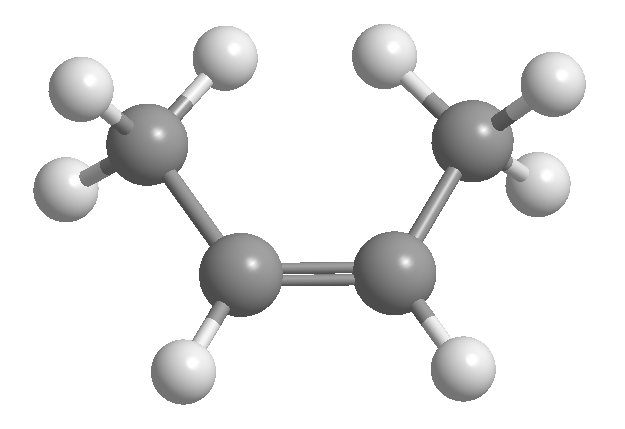
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono. Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.

[1 ] cis-2-buteno
[2 ] trans-2-buteno
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 204995
La palabra quiral fue introducida por William Thomson (Lord Kelvin) en 1894 para designar objetos que no son superponibles con su imagen especular. Aplicado a la química orgánica, podemos decir que una molécula es quiral cuando ella y su imagen en un espejo no son superponibles.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 124124
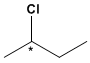 Compuestos con un carbono asimétrico, como puede ser el 2-clorobutano, pueden existir en forma de dos isómeros.
Compuestos con un carbono asimétrico, como puede ser el 2-clorobutano, pueden existir en forma de dos isómeros.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 15932
El número máximo de estereoisómeros que presenta una molécula puede calcularse con la fórmula (2n), donde n representa el número de carbonos asimétricos. Así una molécula con 2 centros quirales presenta 4 estereoisómeros.
Ejemplo 1. Dibujar los posibles estereoisómeros del 2-Bromo-3-clorobutano.
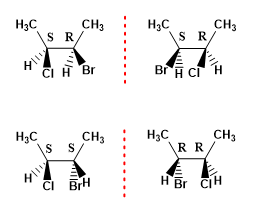
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 152095
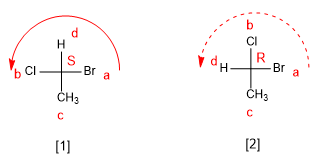
Es necesaria una nomenclatura que distinga los estereoisómeros de una molécula. Así, en el caso del 2-Clorobutano la notación debe distinguir un enantiómero del otro. Cahn, Ingold y Prelog desarrollaron unas reglas que permiten distinguir unos estereoisómeros de otros, y que a continuación describo.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 117004
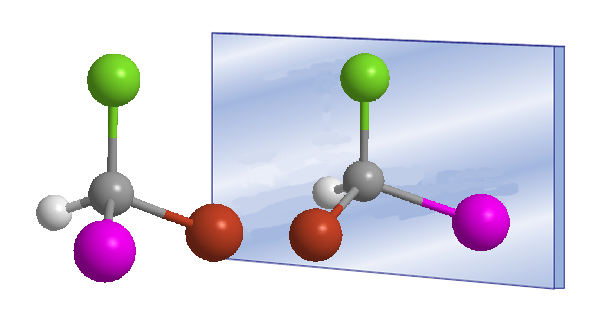
Las moléculas que tienen plano de simetría o centro de inversión son superponibles con su imagen especular. Se dice que son moléculas aquirales.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 173890
La actividad óptica es la capacidad de una sustancia quiral para rotar el plano de la luz polarizada. Se mide usando un aparato llamado polarímetro.
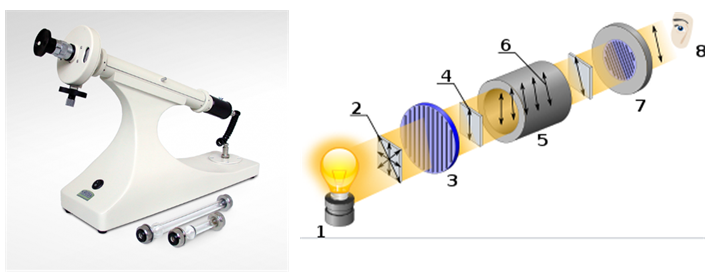
[1 ] Fuente de luz
[2 ] Luz no polarizada
[3 ] Polarizador lineal
[4 ] Luz polarizada linealmente
[5 ] Cubeta con la muestra
[6 ] Rotación en la luz polarizada
[7 ] Analizador
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 208801
Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
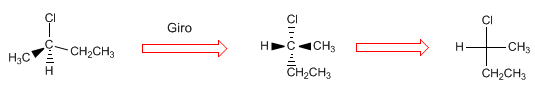
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 119603
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 118034
Para convertir proyecciones de Newman en proyecciones de Fischer se dibuja la forma espacial de la molécula, disponiéndola en conformación eclipsada para hacer la proyección de Fischer.
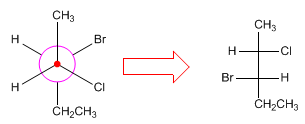
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 124769
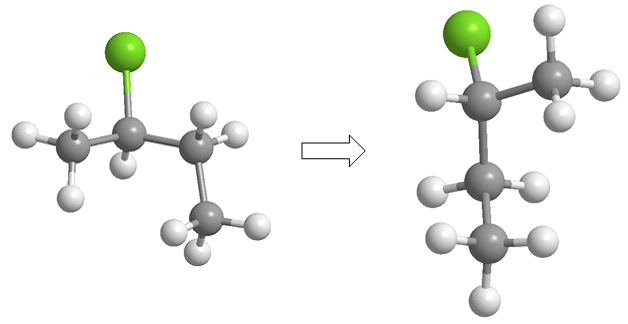
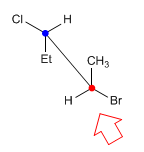 En la proyección de caballete (también llamada en prespectiva) la línea de observación forma un ángulo de 45º con el enlace carbono-carbono. El carbono más proximo al observador se encuentra abajo y a la derecha. Mientras que el más alejado está arriba a la izquierda.
En la proyección de caballete (también llamada en prespectiva) la línea de observación forma un ángulo de 45º con el enlace carbono-carbono. El carbono más proximo al observador se encuentra abajo y a la derecha. Mientras que el más alejado está arriba a la izquierda.
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 14924
Vamos a ver como las reacciones químicas pueden introducir quiralidad en las moléculas, obteniéndose productos en forma de mezclas racémicas o bien mezclas de diastereoisómeros.
El butano se halogena en presencia de bromo y luz, en el carbono 2, para formar una mezcla de enantiómeros. El radical formado presenta caras enantiotópicas, que son halogenadas con igual probabilidad, dando lugar a una mezcla racémica (enantiómeros en igual proporción).
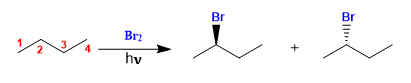
El mecanismo de esta reacción consta de tres etapas: iniciación, propagación y terminación. La propagación es la etapa que determina la estereoquímica del producto final
Halogenación del butano
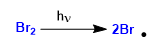
Etapa 1. Iniciación
Etapa 2. Propagación
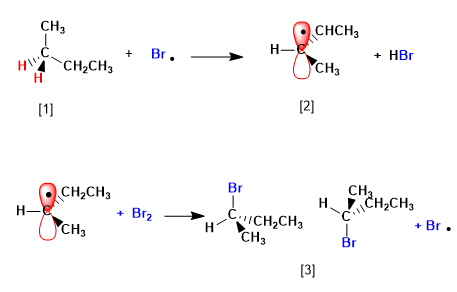
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 11182
Reacción estereoselectiva
- Detalles
- Germán Fernández
- TEORÍA DE ESTEREOQUÍMICA
- Visto: 8791
Dificultades en la separación de racematos