THEORIE DER STEREOCHEMIE
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 1906
Isomer-Definition
Moleküle, die die gleiche Summenformel, aber unterschiedliche Strukturen haben, werden als Isomere bezeichnet. Es wird als Strukturisomere und Stereoisomere klassifiziert.
Strukturisomere
Strukturisomere unterscheiden sich in der Art und Weise, wie die Atome verbunden sind, und werden wiederum in Positions- und funktionelle Kettenisomere eingeteilt.
Stereoisomere
Stereoisomere haben alle identische Bindungen und unterscheiden sich durch die räumliche Anordnung der Gruppen. Sie werden als cis-trans oder geometrische Isomere, Enantiomere und Diastereoisomere klassifiziert.
chirales oder asymmetrisches Zentrum
Ein Atom, das an vier verschiedene Substituenten gebunden ist, wird als chirales oder asymmetrisches Zentrum bezeichnet. Ein Molekül mit einem chiralen Zentrum hat ein nicht überlagerbares Spiegelbild davon, das als Enantiomer bezeichnet wird.
optische Aktivität
Die Enantiomere haben fast alle identische physikalische Eigenschaften, mit Ausnahme der optischen Aktivität. Eines der Enantiomere dreht polarisiertes Licht nach rechts (rechtsgängig) und das andere dreht polarisiertes Licht nach links (linksgängig).
Stereochemie in Reaktionen
Radikalische Halogenierungsreaktionen an Molekülen, in denen Chiralitätszentren gebildet werden können, erzeugen Mischungen von Enantiomeren in gleichen Mengen oder von Diastereoisomeren in unterschiedlichen Anteilen.
Trennung von Enantiomeren
Enantiomere haben fast alle die gleichen physikalischen Eigenschaften, unterscheiden sich im rotationspolarisierten Licht, haben aber die gleichen Schmelz- und Siedepunkte und die gleiche Löslichkeit. Daher können wir die traditionellen Methoden der Trennung nicht anwenden und müssen auf spezielle Techniken zurückgreifen. Die Trennung über Diastereoisomere besteht darin, das Enantiomerengemisch durch Zugabe eines chiralen Reagens in ein Diastereoisomerengemisch umzuwandeln, wobei die Diastereoisomeren leicht durch physikalische Methoden getrennt werden können.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 110113
Stereochemie ist die Untersuchung organischer Verbindungen im Weltraum. Um die Eigenschaften organischer Verbindungen zu verstehen, ist es notwendig, alle drei räumlichen Dimensionen zu betrachten. 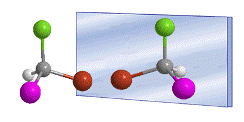 Die Grundlagen der Stereochemie wurden 1874 von Jacobus van't Hoff und Le Bel gelegt. Sie schlugen unabhängig voneinander vor, dass die vier Substituenten eines Kohlenstoffs zu den Ecken eines Tetraeders gerichtet sind, wobei sich der Kohlenstoff in der Mitte des Tetraeders befindet.
Die Grundlagen der Stereochemie wurden 1874 von Jacobus van't Hoff und Le Bel gelegt. Sie schlugen unabhängig voneinander vor, dass die vier Substituenten eines Kohlenstoffs zu den Ecken eines Tetraeders gerichtet sind, wobei sich der Kohlenstoff in der Mitte des Tetraeders befindet.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 292117
Isomere sind Moleküle, die die gleiche Summenformel, aber unterschiedliche Strukturen haben. Es wird als Strukturisomere und Stereoisomere klassifiziert. Strukturisomere unterscheiden sich in der Art und Weise, wie ihre Atome gebunden sind, und werden in Ketten-, Positions- und Funktionsisomere eingeteilt. Als Beispiel wollen wir die Strukturisomere der Formel C 2 H 6 O zeichnen.

[1] Äthanol
[2] Dimethylether
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 262607
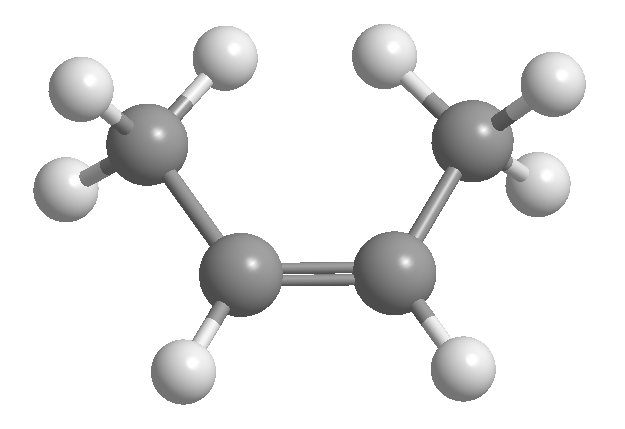
Cis-trans oder geometrische Isomerie ist auf eine eingeschränkte Rotation um eine Kohlenstoff-Kohlenstoff-Bindung zurückzuführen. Diese Einschränkung kann auf das Vorhandensein von Doppelbindungen oder Zyklen zurückzuführen sein. Somit kann 2-Buten in Form von zwei Isomeren vorliegen, die als cis und trans bezeichnet werden. Das Isomer mit den Wasserstoffatomen auf der gleichen Seite heißt cis, das mit den gegenüberliegenden Seiten trans.

[1] cis -2-Buten
[2] trans -2-Buten
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 158537
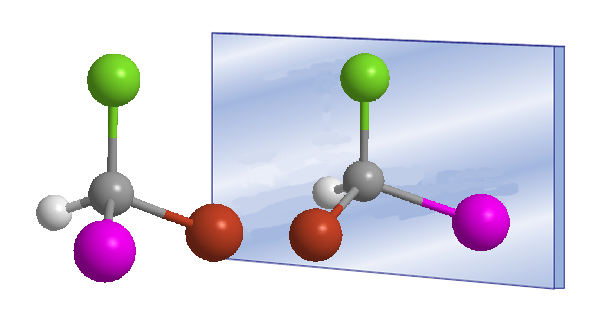
Das Wort chiral wurde 1894 von William Thomson (Lord Kelvin) eingeführt, um Objekte zu bezeichnen, die nicht mit ihrem Spiegelbild überlagert werden können. Übertragen auf die organische Chemie können wir sagen, dass ein Molekül chiral ist, wenn es und sein Spiegelbild nicht zur Deckung gebracht werden können.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 106763
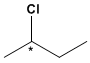 Verbindungen mit einem asymmetrischen Kohlenstoff, wie 2-Chlorbutan, können als zwei Isomere existieren.
Verbindungen mit einem asymmetrischen Kohlenstoff, wie 2-Chlorbutan, können als zwei Isomere existieren.
Weiterlesen: Isomere mit einem einzigen asymmetrischen Kohlenstoff
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 2896
Die maximale Anzahl an Stereoisomeren, die ein Molekül präsentiert, kann mit der Formel (2 n ) berechnet werden, wobei n die Anzahl an asymmetrischen Kohlenstoffatomen darstellt. Somit hat ein Molekül mit 2 Chiralitätszentren 4 Stereoisomere.
Beispiel 1. Zeichnen Sie die möglichen Stereoisomere von 2-Brom-3-chlorbutan.
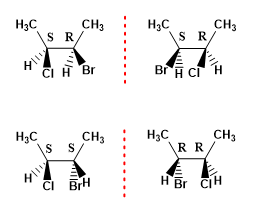
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 128229
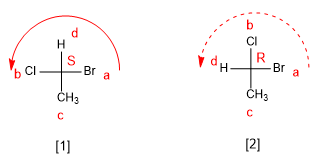
Es ist eine Nomenklatur notwendig, die die Stereoisomere eines Moleküls unterscheidet. Daher muss im Fall von 2-Chlorbutan die Schreibweise ein Enantiomer vom anderen unterscheiden. Cahn, Ingold und Prelog haben einige Regeln entwickelt, die uns erlauben, einige Stereoisomere von anderen zu unterscheiden, die ich unten beschreibe.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 97679
Moleküle, die eine Symmetrieebene oder ein Inversionszentrum haben, sind mit ihrem Spiegelbild überlagerbar. Sie werden als achirale Moleküle bezeichnet.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 134131
Optische Aktivität ist die Fähigkeit einer chiralen Substanz, die Ebene von polarisiertem Licht zu drehen. Es wird mit einem Gerät gemessen, das als Polarimeter bezeichnet wird.
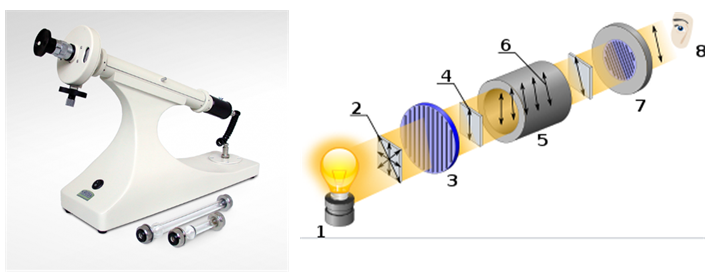
[1 ] Lichtquelle
[2 ] Unpolarisiertes Licht
[3 ] Linearer Polarisator
[4 ] Linear polarisiertes Licht
[5 ] Probenküvette
[6 ] Drehung in polarisiertem Licht
[7] Analysator
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 132392
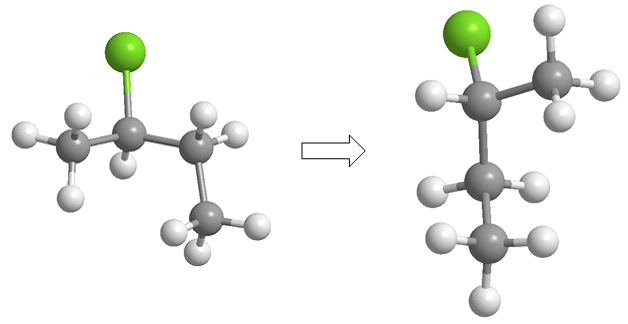
Das Projizieren besteht darin, ein Molekül in zwei Dimensionen (Ebene) zu zeichnen. In der Fischer-Projektion wird das Molekül in Form eines Kreuzes gezeichnet, mit den Substituenten, die in der Vertikalen nach unten in die Ebene gehen, und den Gruppen, die in der Horizontalen zu uns herauskommen, wobei der Schnittpunkt beider Linien den Schnittpunkt darstellt projizierter Kohlenstoff.
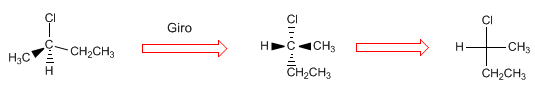
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 94588
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 91528
Um Newman-Projektionen in Fischer-Projektionen umzuwandeln, wird die räumliche Form des Moleküls gezeichnet und in einer verfinsterten Konformation angeordnet, um die Fischer-Projektion zu erstellen.
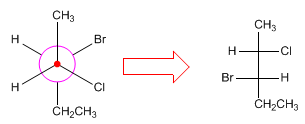
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 89297
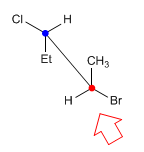 Bei der Staffelei-Projektion (auch perspektivisch genannt) bildet die Beobachtungslinie mit der Kohlenstoff-Kohlenstoff-Bindung einen Winkel von 45º. Der Kohlenstoff, der dem Beobachter am nächsten ist, befindet sich unten und rechts. Während der am weitesten entfernte oben links ist.
Bei der Staffelei-Projektion (auch perspektivisch genannt) bildet die Beobachtungslinie mit der Kohlenstoff-Kohlenstoff-Bindung einen Winkel von 45º. Der Kohlenstoff, der dem Beobachter am nächsten ist, befindet sich unten und rechts. Während der am weitesten entfernte oben links ist.
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 2613
Wir werden sehen, wie chemische Reaktionen Chiralität in Moleküle einführen können, wobei Produkte in Form von racemischen Mischungen oder Mischungen von Diastereoisomeren erhalten werden.
Butan wird in Gegenwart von Brom und Licht an Kohlenstoff 2 halogeniert, um ein Enantiomerengemisch zu bilden. Das gebildete Radikal weist enantiotope Seiten auf, die mit gleicher Wahrscheinlichkeit halogeniert werden, wodurch ein racemisches Gemisch entsteht (Enantiomere in gleichen Anteilen).
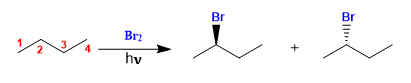
Der Mechanismus dieser Reaktion besteht aus drei Stufen: Initiierung, Ausbreitung und Beendigung. Die Vermehrung ist der Schritt, der die Stereochemie des Endprodukts bestimmt.
Butanhalogenierung
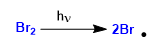
Stufe 1. Einweihung
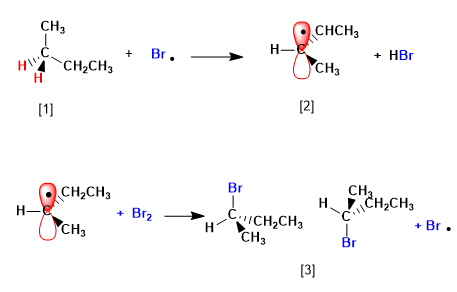
Stufe 2. Ausbreitung
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 4162
Stereoselektive Reaktion
- Details
- Germán Fernández
- THEORIE DER STEREOCHEMIE
- Zugriffe: 2958
Schwierigkeiten bei der Trennung von Racematen