THÉORIE DE LA STÉRÉOCHIMIE
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 1869
isomère définition
Les molécules qui ont la même formule moléculaire mais des structures différentes sont appelées isomères. Il est classé en isomères structuraux et en stéréoisomères.
isomères structuraux
Les isomères structuraux diffèrent par la manière dont les atomes sont joints et sont à leur tour classés en isomères de chaîne de position et fonctionnels.
stéréoisomères
Les stéréoisomères ont toutes des liaisons identiques et se différencient par la disposition spatiale des groupes. Ils sont classés en cis-trans ou isomères géométriques, énantiomères et diastéréoisomères.
centre chiral ou asymétrique
Un atome lié à quatre substituants différents est appelé centre chiral ou asymétrique. Une molécule qui a un centre chiral en a une image miroir non superposable, appelée énantiomère.
activité optique
Les énantiomères ont presque tous des propriétés physiques identiques, à l'exception de l'activité optique. L'un des énantiomères fait tourner la lumière polarisée vers la droite (droitier) et l'autre fait tourner la lumière polarisée vers la gauche (gaucher).
stéréochimie dans les réactions
Les réactions d'halogénation radicalaire sur des molécules dans lesquelles des centres chiraux peuvent se former produisent des mélanges d'énantiomères en quantités égales ou de diastéréoisomères en proportions différentes.
séparation des énantiomères
Les énantiomères ont presque tous les mêmes propriétés physiques, diffèrent par la lumière polarisée en rotation, mais ont les mêmes points de fusion et d'ébullition et une solubilité identique. Par conséquent, nous ne pouvons pas appliquer les méthodes traditionnelles de séparation et nous devons recourir à des techniques spéciales. La séparation via des diastéréoisomères, consiste à transformer le mélange d'énantiomères en un mélange de diastéréoisomères en ajoutant un réactif chiral, les diastéréoisomères sont facilement séparés par des méthodes physiques.
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 110504
La stéréochimie est l'étude des composés organiques dans l'espace. Pour comprendre les propriétés des composés organiques, il est nécessaire de considérer les trois dimensions spatiales. 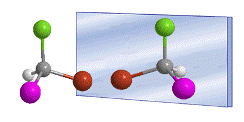 Les bases de la stéréochimie ont été posées par Jacobus van't Hoff et Le Bel, en 1874. Ils ont indépendamment proposé que les quatre substituants d'un carbone soient dirigés vers les sommets d'un tétraèdre, avec le carbone au centre du tétraèdre. .
Les bases de la stéréochimie ont été posées par Jacobus van't Hoff et Le Bel, en 1874. Ils ont indépendamment proposé que les quatre substituants d'un carbone soient dirigés vers les sommets d'un tétraèdre, avec le carbone au centre du tétraèdre. .
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 292823
Les isomères sont des molécules qui ont la même formule moléculaire mais des structures différentes. Il est classé en isomères structuraux et en stéréoisomères. Les isomères structuraux diffèrent par la manière dont leurs atomes sont liés et sont classés en isomères de chaîne, de position et de fonction. A titre d'exemple, dessinons les isomères structuraux de formule C 2 H 6 O .

[1] Éthanol
[2] Éther diméthylique
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 263970
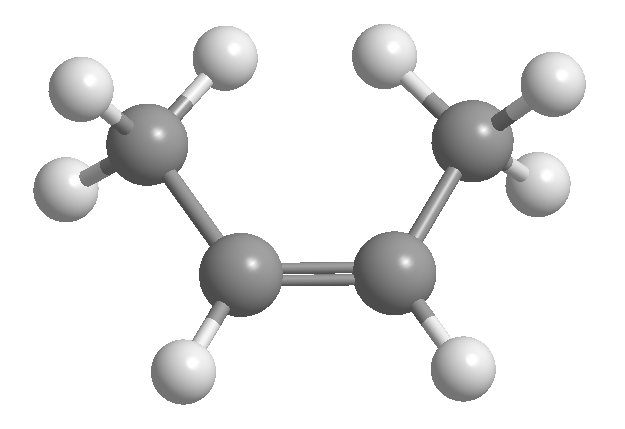
L'isomérie cis-trans ou géométrique est due à une rotation restreinte autour d'une liaison carbone-carbone. Cette restriction peut être due à la présence de doubles liaisons ou de cycles. Ainsi, le 2-butène peut exister sous la forme de deux isomères, appelés cis et trans. L'isomère avec les hydrogènes du même côté est appelé cis, et celui avec les côtés opposés est appelé trans.

[1] cis -2-butène
[2] trans -2-butène
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 159807
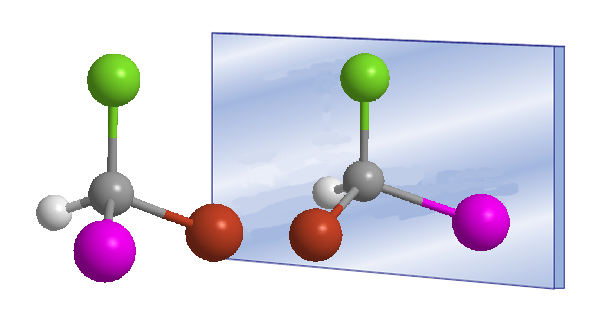
Le mot chiral a été introduit par William Thomson (Lord Kelvin) en 1894 pour désigner des objets non superposables à leur image miroir. Appliquée à la chimie organique, on peut dire qu'une molécule est chirale lorsqu'elle et son image miroir ne sont pas superposables.
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 107359
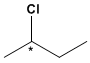 Les composés à carbone asymétrique, comme le 2-chlorobutane, peuvent exister sous forme de deux isomères.
Les composés à carbone asymétrique, comme le 2-chlorobutane, peuvent exister sous forme de deux isomères.
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 3097
Le nombre maximal de stéréoisomères qu'une molécule présente peut être calculé avec la formule (2 n ), où n représente le nombre de carbones asymétriques. Ainsi, une molécule à 2 centres chiraux possède 4 stéréoisomères.
Exemple 1. Dessinez les stéréoisomères possibles du 2-bromo-3-chlorobutane.
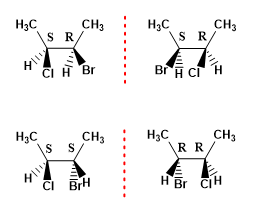
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 128447
Il faut une nomenclature qui distingue les stéréoisomères d'une molécule. Ainsi, dans le cas du 2-Chlorobutane la notation doit distinguer un énantiomère de l'autre. Cahn, Ingold et Prelog ont développé des règles qui nous permettent de distinguer certains stéréoisomères des autres, que je décris ci-dessous.
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 97997
Les molécules qui ont un plan de symétrie ou un centre d'inversion sont superposables avec leur image miroir. On dit qu'il s'agit de molécules achirales.
Lire la suite : Symétrie dans les molécules chirales : formes méso
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 136166
L'activité optique est la capacité d'une substance chirale à faire tourner le plan de la lumière polarisée. Elle est mesurée à l'aide d'un appareil appelé polarimètre.
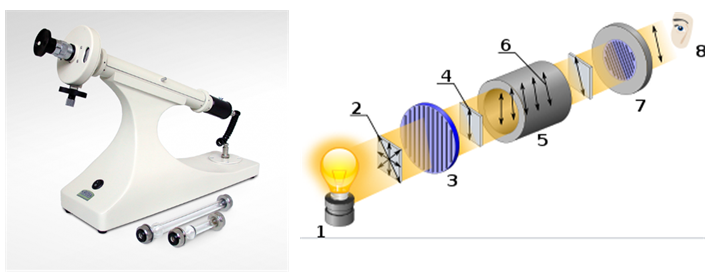
[1 ] Source lumineuse
[2 ] Lumière non polarisée
[3 ] Polariseur linéaire
[4 ] Lumière polarisée linéairement
[5 ] Cuvette d'échantillon
[6 ] Rotation en lumière polarisée
[7 ] Analyseur
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 138938
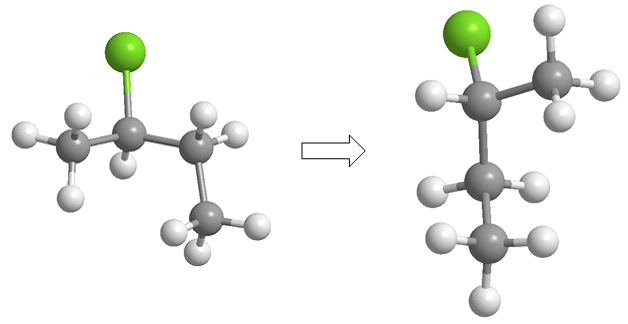
La projection consiste à dessiner une molécule en deux dimensions (plan). Dans la projection de Fischer, la molécule est dessinée en forme de croix avec les substituants qui vont vers le bas du plan à la verticale et les groupes qui sortent vers nous à l'horizontale, le point d'intersection des deux lignes représente le carbone projeté.
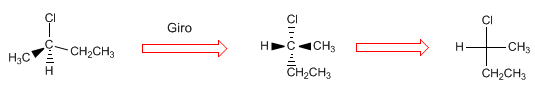
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 93573
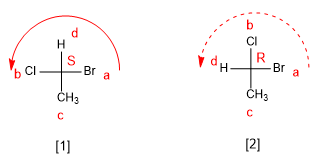
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 97069
Pour convertir les projections de Newman en projections de Fischer, la forme spatiale de la molécule est dessinée, en l'arrangeant dans une conformation éclipsée pour faire la projection de Fischer.
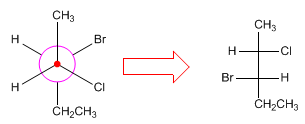
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 89999
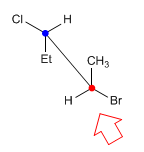 Dans la projection de chevalet (également appelée en perspective), la ligne d'observation fait un angle de 45º avec la liaison carbone-carbone. Le carbone le plus proche de l'observateur est en bas et à droite. Alors que le plus éloigné est en haut à gauche.
Dans la projection de chevalet (également appelée en perspective), la ligne d'observation fait un angle de 45º avec la liaison carbone-carbone. Le carbone le plus proche de l'observateur est en bas et à droite. Alors que le plus éloigné est en haut à gauche.
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 2851
Nous allons voir comment des réactions chimiques peuvent introduire la chiralité dans les molécules, obtenant des produits sous forme de mélanges racémiques ou de mélanges de diastéréoisomères.
Le butane s'halogène en présence de brome et de lumière, au niveau du carbone 2, pour former un mélange d'énantiomères. Le radical formé présente des faces énantiotopiques, qui sont halogénées avec une probabilité égale, donnant naissance à un mélange racémique (énantiomères en égale proportion).
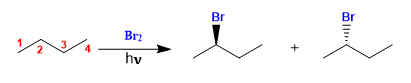
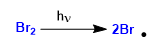
Le mécanisme de cette réaction comporte trois étapes : initiation, propagation et terminaison. La propagation est l'étape qui détermine la stéréochimie du produit final.
halogénation du butane
Étape 1. Initiation
Étape 2. Propagation
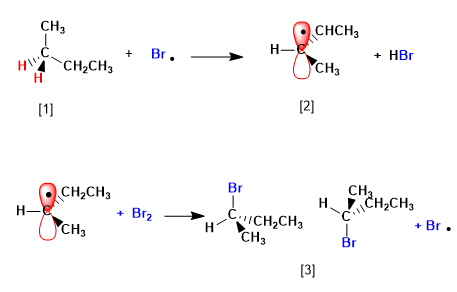
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 9005
réaction stéréosélective
- Détails
- Germán Fernández
- THÉORIE DE LA STÉRÉOCHIMIE
- Affichages : 5902
Difficultés à séparer les racémates