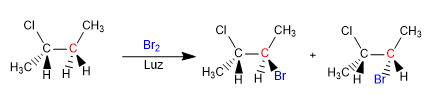
Nous allons voir comment des réactions chimiques peuvent introduire la chiralité dans les molécules, obtenant des produits sous forme de mélanges racémiques ou de mélanges de diastéréoisomères.
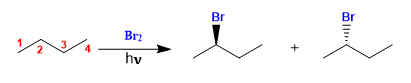
Le butane s'halogène en présence de brome et de lumière, au niveau du carbone 2, pour former un mélange d'énantiomères. Le radical formé présente des faces énantiotopiques, qui sont halogénées avec une probabilité égale, donnant naissance à un mélange racémique (énantiomères en égale proportion).
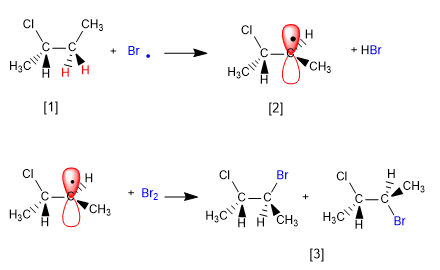
Le mécanisme de cette réaction comporte trois étapes : initiation, propagation et terminaison. La propagation est l'étape qui détermine la stéréochimie du produit final.
halogénation du butane
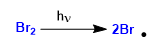
Étape 1. Initiation
Étape 2. Propagation
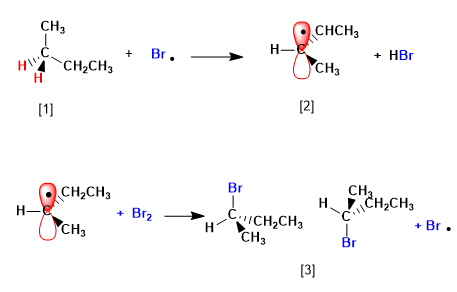
[1] H (hydrogènes énantiotopiques)
[2] Radical à faces énantiotopiques
[3] Paire d'énantiomères
Le produit est obtenu sous forme de mélange racémique, du fait de la formation d'un radical planaire halogéné sur les deux faces. Les hydrogènes énantiotopiques sont chimiquement équivalents et sont soustraits par le brome à la même vitesse.