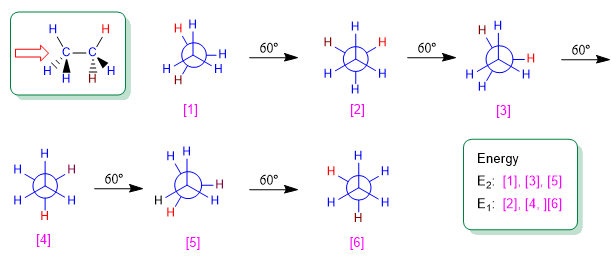
L'éthane est l'alcane le plus simple qui puisse exister sous différentes conformations. Parmi les conformations infinies qui peuvent être obtenues en tournant la liaison carbone-carbone, les conformations alternées et éclipsées se distinguent par leur importance.
Conformation alternée de l'éthane
Comme on peut le voir sur la figure, la conformation alternée a les hydrogènes du premier carbone situés entre les hydrogènes du deuxième carbone, il n'y a pas d'hydrogènes opposés. 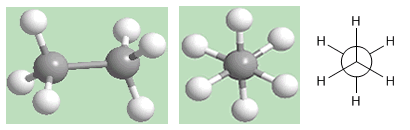
Dans cette conformation, les liaisons carbone-hydrogène des deux carbones sont éloignées, formant des angles de 60º. La conformation décalée est la plus stable des conformations d'éthane. C'est-à-dire celui qui a la plus faible énergie.
Conformation éclipsée de l'éthane
La deuxième conformation est dite éclipsée. Dans celui-ci, les liaisons carbone-hydrogène des deux carbones se font face (éclipsées). Les champs électroniques des hydrogènes opposés subissent d'importantes répulsions (éclipses) qui déstabilisent la conformation. La conformation éclipsée de l'éthane est celle dont l'énergie est la plus élevée. C'est-à-dire le plus instable. 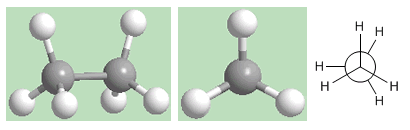
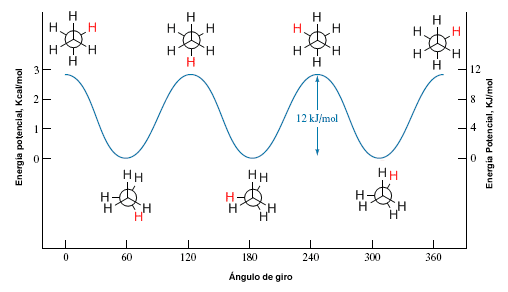
La rotation autour d'une simple liaison carbone-carbone n'est pas complètement libre, en raison des différences d'énergie entre les conformations décalées et éclipsées. Pour que la rotation ait lieu, il est nécessaire de surmonter une barrière énergétique qui est donnée par l'énergie de la conformation éclipsée (énergie d'activation). Dans l'éthane, cette barrière énergétique est petite, environ 2,9 Kcal/mol (12 KJ/mol), et permet aux conformères de s'interconvertir à grande vitesse.
Diagramme d'énergie potentielle
Un diagramme d'énergie potentielle nous permet de comprendre comment l'énergie potentielle du système change pendant la rotation. Ces diagrammes représentent l'énergie potentielle de la molécule par rapport à l'angle de rotation.